Ce cas de blastocystose sur des porcs qui a été vu à la Clinique Universitaire Porcine, est arrivé en mars 2015 dans un élevage de truies autrichien. Dans cet élevage, il y a 60 truies en lots de 3 semaines avec une lactation de 28 jours dans un système de production naisseur-engraisseur. Les truies sont vaccinées régulièrement contre la parvovirose et le rouget alors que les porcelets sont vaccinés contre le PCV2 et Mycoplasma hyopneumoniae. On ne nous a pas signalé d’autres maladies.

Symptômes
Le vétérinaire a observé des porcelets avec de la diarrhée après le sevrage avec pour conséquence une diminution sur le gain de poids. On n’a pas observé d’autres symptômes cliniques. La mortalité était faible avec un taux < 5%. On a mis en place plusieurs mesures thérapeutiques comme une thérapie antimicrobienne et l’adaptation de l’aliment (diminution de la protéine brute de 18 à 15% et augmentation de la fibre brute de 3 à 4%) qui n’ont pas permis la récupération des porcelets. Sur ce point, on nous a consultés pour diagnostiquer la cause de la diarrhée.
Examen clinique et premières avancées diagnostiques
Un porcelet qui avait été traité avec de la colistine (5 mg/kg de poids vif/jour pendant 7 jours) avec de la diarrhée abondante caractéristique a été envoyé à la Clinique Universitaire Porcine. Les résultats de l’examen clinique ont seulement montré un état nutritionnel modérément diminué et de la diarrhée. Après l’examen clinique, le porcelet fut euthanasié pour réaliser l’autopsie et l’examen histopathologique. Un fragment du jéjunum a été traité séparément pour son analyse bactériologique. On a prélevé des échantillons de fèces diarrhéiques avec un tube (complètement rempli pour assurer des conditions anaérobies) et on les a envoyés immédiatement à l’Institut de Bactériologie pour la culture de Brachyspira spp. Pour exclure l’entérite associée au PCV2, on a fixé des échantillons de tissu dans du formol sur lesquels on a réalisé une hybridation in situ pour détecter le PCV2 directement dans l’intestin. On a analysé un grattage de muqueuse de l’iléon et du côlon pour détecter Lawsonia intracellularis, Brachyspira hyodysenteriae et Brachyspira pilosicoli en utilisant une triple PCR. Pour détecter les ookystes coccidiens et les protozoaires, on a réalisé une microscopie des fèces en fluorescence et sous lumière conventionnelle.
Résultats Pathologiques
On n’a pas détecté d’altérations morphopathologiques appréciables dans les organes. Le contenu du côlon était de couleur vert clair et liquide. Sur la muqueuse de l’intestin grêle, on a observé différents granulocytes éosinophiles par l’examen histopathologique (figure 1). L’hybridation in situ pour le PCV2 comme la triple PCR pour la détection de L. intracellularis, B. hyodysenteriae et B. pilosicoli ont été négatives.
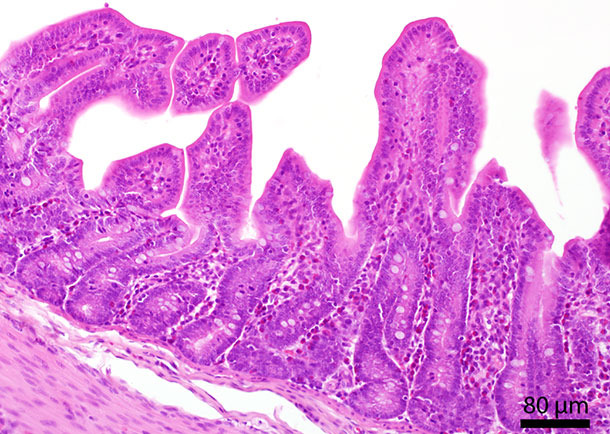
Figure 1 : Section histologique de l’intestin grêle. On a localisé plusieurs granulocytes éosinophiles dans la muqueuse.
Résultats bactériologiques
Dans le jéjunum, on a trouvé une faible densité de champignons (levures) et d’Escherichia coli. A cause de la faible détection d’E. coli dans le jéjunum, on a supposé qu’il avait un faible impact clinique et on n’a donc pas déterminé les facteurs de virulence. Il faut ajouter que l’on n’a pas détecté Brachyspira spp sur les cultures spécifiques.
Résultats parasitologiques
On n’a pas détecté d’ookystes de coccidies par la microscopie en fluorescence. On a détecté des kystes de Neobalantidium coli en quantité considérée physiologique pour le côlon porcin.
On a trouvé à la microscopie avec la lumière conventionnelle dans les fèces de ce porcelet, beaucoup de structures arrondies d’une taille de 10-20 µm. Ces structures semblaient transparentes sans ou presque sans composants « intracellulaires » (fig 2)
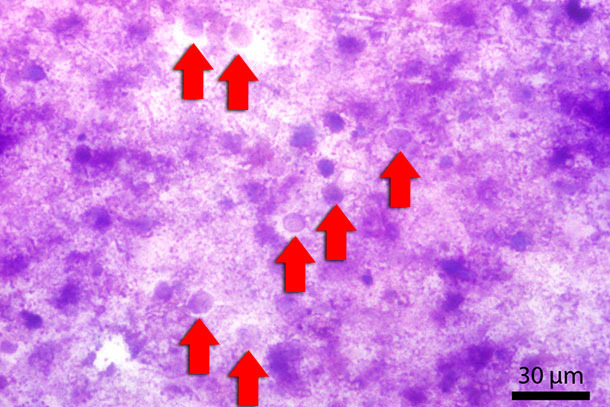
Fig. 2: Frottis fécal coloré avec Diff-Quick. Les flèches rouges indiquent les Blastocystis.
Pour mieux voir ces structures, on a coloré un frottis fécal avec un kit commercial de Diff-Quick. Avec un agrandissement x 1000 en utilisant la lumière de microscopie en immersion, les structures semblaient unicellulaires, particulièrement basophiles. Du fait que, selon nos connaissances, ces structures ne se trouvent généralement pas dans ces quantités dans les fèces des porcs, on pense qu’il s’agissait de quelque chose de « nouveau ». Après consultation avec des pathologistes, des bactériologues et des parasitologues, on a eu le diagnostic final d’un protistologue qui travaillait autant avec des protozoaires vétérinaires que des humains. On a décrit ces structures comme Blastocystis sp.
Interprétation de ces découvertes
Du fait que l’on n’ait trouvé aucun entéro-pathogène en quantité cliniquement importante, l’infestation massive de Blastocystis sp est considérée comme significative dans ce cas.
Blastocystis sp est un protozoaire qui se trouve fréquemment chez les humains et les animaux comme les truies et les vaches. La cellule est entourée par une membrane cellulaire et est constituée principalement d’une grande vacuole centrale. Le noyau est localisé marginalement (figure 3). On l’a décrit pour la première fois en 1911 mais sa pathogénèse et sa pathogénicité ne sont pas encore du tout connues. Blastocystis peut se trouver physiologiquement en quantités modérées dans le côlon des porcs. Les études qui cherchent la blastocystose chez les porcs immunodéprimés montrent une colonisation probable non seulement du côlon mais aussi de l’intestin grêle. On n’observe en général pas de lésions ni de colonisation épithéliale du tissu intestinal ni chez les humains ni chez les porcs.
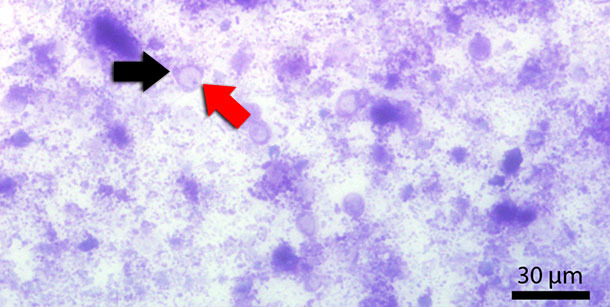
Fig. 3 : Frottis fécal coloré par Diff-Quick. La flèche rouge signale la vacuole centrale et la noire le noyau.
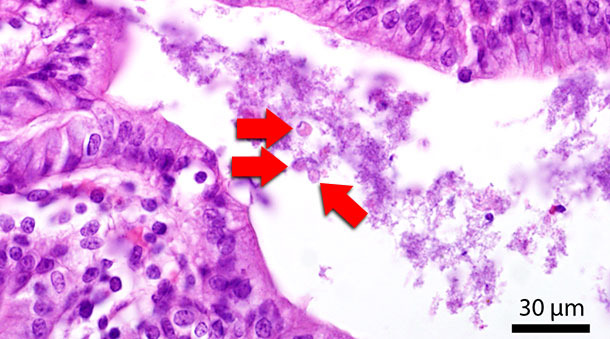
Fig. 4 Section histologique du côlon. Les flèches rouges montrent Blastocystis dans la lumière intestinale.
Dans le cas présent, la raison de la colonisation massive de l’intestin des porcelets serait l’immunosuppression due à la contamination par des mycotoxines. En 2014, le maïs a été très contaminé par des mycotoxines particulièrement les trichothécènes des types A et B, dans toute l’Europe centrale. Le déoxynivalénole (DON) appartenant aux trichothécènes du groupe B et la toxine T2 appartenant au groupe A, sont des mycotoxines connues pour leur effet immunosuppresseur. Etant donné la contamination élevée du maïs, on avait décidé de l’éliminer complètement de l’aliment. Cependant, on pense que les mycotoxines (particulièrement T2 et DON) ont été les composants immunosuppresseurs qui ont permis la colonisation avec Blastocystis des lots précédents. Ce fait, conjointement avec le manque de procédés adéquats d’hygiène et de désinfection, pourraient avoir permis une contamination extraordinaire dans les cases avec des phases infectieuses de Blastocystis, qui ont touché les lots suivants.
Prophylaxie et traitement
Le traitement de la blastocystose est difficile à cause du nombre limité de substances efficaces pour la combattre. Le métronidazole serait le produit de choix mais son utilisation chez les animaux de production n’est pas encore autorisée par l’UE. D’autres imidazoles comme le tinidazole et le kétoconazole ne sont pas non plus autorisés.
Le seul moyen légal de traiter la blastocystose est le triméthoprime-sulfonamide (TMP/STX) oral ou la paromomycine, administrée dans l’eau de boisson. La paromomycine est un antimicrobien du groupe des amino-glucosides qui est peu absorbée par voir systémique. Une fois consommée, elle reste dans la lumière intestinale et est excrètée dans les fèces. En médecine humaine, la paromomycine est utilisée pour traiter la blostocystose, la cryptosporidiose, l’amibiase et la leishmaniose cutanée.
Dans ce cas, on a administre du TMP/STX dans l’aliment pour traiter la diarrhée mais on n’a détecté aucune amélioration des symptômes. Ainsi, le vétérinaire a décidé d’utiliser la paromomycine à une dose de 40 mg/kg de poids vif pendant 10 jours comme s’il s’agissait d’un traitement antimicrobien puisque c’est un produit enregistré pour cet usage. Ce produit est aussi autorisé pour le traitement de l’entérite due à E. coli.
Le traitement antibiotique de Blastocystis n’est pas efficace en lui-mêle. Il doit toujours être accompagné de mesures de conduite comme le nettoyage et la désinfection adaptée. Même s’il n’y a pas d’information disponible, on suppose que les désinfectant à base de crésol ou de composants d’ammonium quaternaire/glutaraldéhyde sont efficaces. On doit tenir compte de tout autre agent infectieux immunosuppresseur et traiter si nécessaire. Si on suspecte que les mycotoxines ont pu entraîner la maladie, on peut mettre en place l’application d’additifs efficaces dans l’aliment.
Suivi
Après plusieurs mois, la situation clinique dans l’élevage s’est considérablement améliorée. La paromomycine a été utilisée avec succès sur trois lots. On n’a pas observé plus de diarrhée sur les lots traités avec la parmomycine et le taux de mortalité a baissé jusqu’à < 1%. Cependant, comme le traitement des porcelets sevrés avec la paromomycine était très cher, le vétérinaire a arrêté la métaphylaxie antimicrobienne contre Blastocystis et a commencé à supplémenter l’aliment avec de l’oxyde de zinc à 2500 ppm et du charbon pour aider les animaux atteints. Actuellement, ceci a été suffisant pour prévenir la diarrhée sur les porcelets sevrés jusqu’à maintenant.
Résumé et perspectives
En résumé, on doit ajouter Blastocystis sp à la liste des diagnostics différentiels dans les cas de diarrhée porcine, particulièrement sur les années où le maïs a été très contaminé par les mycotoxines connues pour leur effet immunosuppresseur. A l’avenir les laboratoires devraient élargir leur terrain de diagnostic et chercher Blastocystis sp dans les fèces des porcs à diarrhée abondante.





