Méthodes pour détecter les anticorps du SDRPv
L’immunofluorescence indirecte (IFA), la séroneutralisation du virus(SN), l’immunopéroxydase en monocouche (IPMA) et l’immuno-absorption enzymatique (ELISA) ont été utilisés pour la détection d’anticorps spécifiques contre le SDRPv. Aujourd’hui, l’IFA, la SN et l’ELISA peuvent être réalisées dans la plupart des laboratoires de diagnostic vétérinaire nord-américains alors qu’en Europe on utilise beaucoup l’IPMA. Toutes les analyses sont considérées spécifiques avec différents niveaux de sensibilité. Généralement, l’IFA, l’ELISA et l’IPMA servent à détecter les anticorps totaux de l’isotype IgG spécifique pour le SDRPv alors que la SN est utilisée pour détecter les anticorps fonctionnels associés à l’immunité ou à la protection immunitaire. L’IFA et l’ELISA ont été adaptées pour détecter d’autres isotypes comme les IgM ou les IgA (figure 1). Les anticorps IgG spécifiques pour le SDRPv qui peuvent être détectés par l’IFA, l’IPMA ou l’ELISA sont produits chez les porcs infectés entre 7 et 14 jours après l’infection. Cependant, les anticorps SN peuvent être détectés même 1 à 2 mois après l’infection (figure 2). Généralement, les anticorps contre le SDRPv des infections actives peuvent être détectés de façon précise de 3 à 4 mois après l’infection et peuvent durer 6 mois jusqu’à un an après l’épisode.

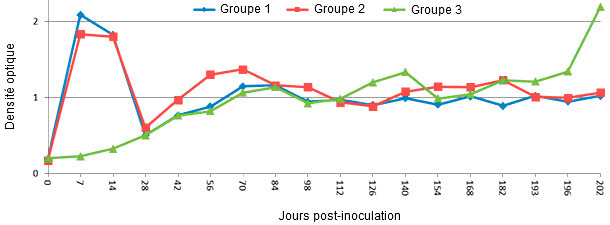
Figure 1 : Réponse des IgM sur des jeunes porcs après une infection expérimentale avec le SDRPv mesurée par IDEXX SDRP ELISA 2 XR avec modifications. Les groupes 1 et 2 ont été inoculés avec du SDRPv de type 2 par voie intranasale le jour 0. Le groupe 1 a été réinoculé à 196 jours post-inoculation alors que le groupe 3 n’a pas été inoculé avec le SDRPv jusqu’à 196 jpi. Les anticorps IgM spécifiques pour le SDRPv peuvent être détectés à partir de 7 jpi et diminuent rapidement après 14 jpi (Nezami S and Yoon KJ, données non publiées).
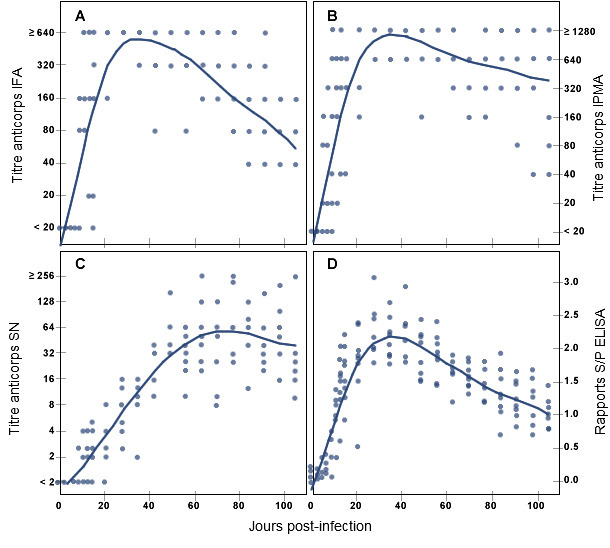
Figure 2 : Réponse des anticorps spécifiques contre le SDRPv pendant une période de temps après l’infection expérimentale chez les porcs, mesurée par le test d’immunofluorescence indirecte (A), l’analyse d’immunoperoxydase en monocouche (B), le test de séroneutralisation du virus (C) et l’analyse d’immuno-absorption enzymatique (D). (Adapté de la publication de Yoon K-J, et al. : Characterization of the humoral immune response to PRRSV infection. Journal of Veterinary Diagnostic Investigation, 7 :305-312, 1995)
Pour les tests IFA et IPMA, on utilise comme antigène des cellules infectées par le virus (figure 3).Un des avantages de ces tests par rapport à l’ELISA est que l’on peut déterminer le titre d’anticorps. Cependant, les critères d’évaluation des titres des anticorps IFA varient souvent entre les techniciens et les laboratoires puisque l’interprétation est subjective. De plus, les résultats du test ou les critères d’appréciation des titres d’anticorps varieront en fonction du niveau où la souche de SDRPv utilisée dans l'essai diffère antigéniquement de l’isolat responsable de l'infection.
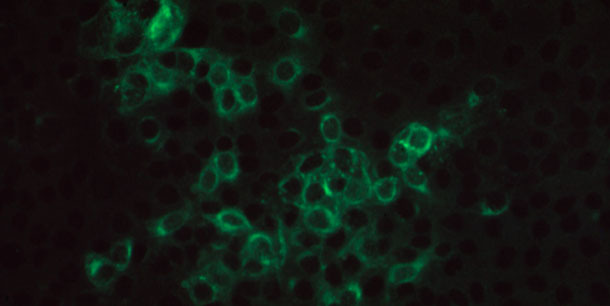
Figure 3 : Photo microscopique d’immunofluorescence positive en monocouche de cellules MARC145 infectées par le SDRPv, incubées avec sérum porcin qui contient des anticorps IgG spécifiques pour le SDRPv et colorées avec des anticorps de chèvre anti-IgG de porc conjugués avec FITC
SOn pense que l’ELISA est plus sensible que l’IFA et l’IPMA. Différentes méthodes d’ELISA ont été décrites : un ELISA indirect qui utilise un quotient échantillon/positif (S/P), un ELISA indirect qui utilise des valeurs de DO directe et l’ELISA de blocage. Aujourd’hui, il y a différents kits ELISA commerciaux disponibles pour la détection d’anticorps sérologiques spécifiques pour le SDRPv (figure 4). L’uniformité dans la fabrication du kit et le degré élevé d’automatisation dans la réalisation du test en laboratoire de diagnostic donnent lieu à une variation plus faible dans les résultats du kit commercial d’ELISA par rapport à d’autres analyses. Les autres avantages du kit commercial sont : a) la détection d’anticorps contre les deux types de SDRPv : b) le temps de réponse rapide ; c) l’autorisation. Dernièrement, le système ELISA a été aussi adapté pour l’analyse d’échantillons de fluide oral pour détecter des anticorps SDRPv dans le cadre du suivi de l’élevage.

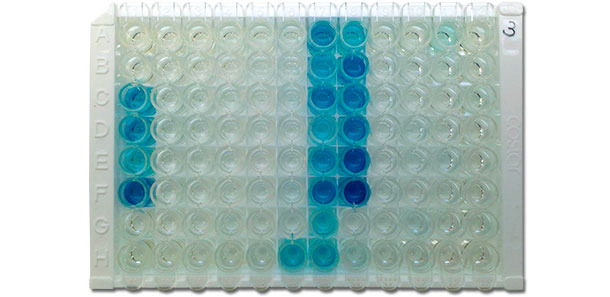
Figure 4 : photographie d’une plaque IDEXX ELISA X3 qui montre des résultats positifs (couleur bleue) et négatifs (incolore). La densité de couleur est en relation avec le niveau d’anticorps du sang, c’est-à-dire, plus la couleur est sombre, plus le titre d’anticorps est élevé., es decir, cuanto más oscuro es el color, más alto es el título de anticuerpos.
(Photo due à la courtoisie de: Dr. David Baum, Iowa State University Veterinary Diagnostic Laboratory)
L’analyse SN est aussi un test spécifique mais des études précédentes ont montré que la SN est moins sensible que l’IFA ou l’ELISA. La faible sensibilité du test est dû principalement au fait que les anticorps neutralisants contre le SDRPv se développent lentement et tard. Etant un test laborieux, il est préférable de considéré le test SN comme un outil de recherche et non comme un test diagnostic de routine. Comme pour l’IFA et l’IPMA, les résultats de la SN sont très influencés par le niveau de relation antigénique enter la souche utilisée et l’isolat responsable de l’infection.
Interprétation des résultats sérologiques dans le diagnostic du SDRP
La sérologie est utile pour confirmer la présence (c’est-à-dire la séropositivité) et l’état (par exemple les niveaux élevés d’anticorps dans des infections récentes) de l’infection par le SDRPv dans l’élevage. L’information sérologique à partir d’un seul échantillon ne sert pas à diagnostiquer le SDRP clinique sur un seul animal puisque l’infection par le SDRPv a une prévalence très élevée dans les élevages de porcs. En interprétant les résultats sérologiques chez les jeunes porcs, on doit considérer l’éventuelle présence d’anticorps maternels. Il est aussi important de tenir compte du fait que les tests sérologiques actuels utilisés dans le diagnostic ne peuvent pas différencier de façon systématique les anticorps induits par le vaccin et les anticorps induits par les isolats de terrain. De plus, on a enregistré la présence de possibles faux positifs de SDRPv même avec les kits ELISA commerciaux. Un résultat sérologique négatif SDRP des échantillons à un moment ponctuel a plusieurs interprétations possibles comme : a) les porcs ne sont pas infectés par le virus ; b) les porcs ont été récemment infectés par le virus et n’ont pas encore séroconverti ; c) les porcs ont été infectés par le virus mais se sont séronégativés ; et d) le résultat a été négatif à cause de la faible sensibilité du test ou à cause d’une erreur du laboratoire. Par conséquent, au lieu d’utiliser un seul échantillon ponctuel, la sérologie SDRP doit être utilisée avec des méthodes d’échantillonnage de populations valides pour déterminer si un élevage a été exposé au SDRPv et non pour déterminer si un animal est infecté.
Pour déterminer l’état d’infection par le SDRPv d’un élevage, on recommande en général l’analyse de jeunes porcs au lieu de reproducteurs. Dans les élevages naisseurs-engraisseurs, sur un seul site, la séroprévalence de l’infection par le SDRPv est généralement considérée plus élevée que dans les engraissements-finition. Normalement, le sang de 10 porcs en finition est suffisant pour déterminer si l’élevage a été exposé au SDRPv. Pour les systèmes de production multi-sites, chaque stade de production représente une seule population, par conséquent chaque site doit être prélevé. Le prélèvement d’une série d’échantillons de sang aux différents stades de production est très utile pour déterminer l’âge auquel l’infection par le SDRPv est la plus fréquente.
Le diagnostic sérologique de l’infection par le SDRPv comme responsable de trouble de la reproduction ou de maladie respiratoire peut-être atteint en démontrant la séroconversion entre deux périodes d’échantillonages de sang ou un changement de titre des anticorps (c’est-à-dire l’élévation du titre de l’anticorps) entre deux échantillons de sang. Cependant, les truies peuvent être exposées au virus deux semaines ou plus avant l’apparition des signes cliniques auquel cas il se peut que l’on n’observe pas l’augmentation des titres d’anticorps. La présence d’anticorps SDRP dans les fluides fœtaux ou dans le sang récolté de porcelets mort-nés ou chétifs avant l’ingestion de colostrum est aussi indicatrice d’infection par le SDRPv. Cependant, une évaluation diagnostique définitive du SDRP par rapport à la maladie clinique demande que l’information sérologique soit interprétée avec les résultats d’autres essais viraux.









