Description de l’élevage
Cet article décrit un cas clinique apparu en reproduction dans un élevage naisseur-engraisseur grec. La capacité de l’élevage était de 650 truies en production (hybrides commerciales Large White × Landrace) et avait un noyau de 35 grand parentales pour la production des F1 de renouvellement. Les truies sevrées et celles de renouvellement étaient logées en cases individuelles pendant 30 à 35 jours où elles étaient inséminées deux fois artificiellement avec de la semence fraîche du même verrat. A 30-35 jours de gestation, les truies étaient transférées dans des cases où elles étaient logées en groupe (10 animaux/lot). Le schéma vaccinal des truies reproductrices et des porcelets sevrés est présenté sur le tableau 1. Le programme antiparasitaire préventif comprenait une seule injection d’ivermectine 14 jours avant la mise-bas pour les femelles, et deux fois par an pour les verrats.

L’élevage était séropositif en SDRP et un an avant ce cas, il s’est produit un épisode de SDRP sur les truies reproductrices et en engraissement (selon les résultats de la PCR, 30% des truies, 90% des sevrés et 35% des porcs d’engraissement étaient positifs).
Tableau 1 : Protocole vaccinal des truies reproductrices et des sevrés
| Vaccin | Protocole |
| Nullipares | |
| Virus Aujeszky | 90 + 120 jours de vie |
| Parvovirus + Erisipelas | 150 + 180 jours de vie |
| Rhinite atrophique | 150 + 180 jours de vie |
| SDRPv | 180 + 210 jours de vie |
| Escherichia coli + Clostridium perfringens | 160 + 190 jours de vie |
| Truies | |
| Virus Aujeszky | 4 semaines avant la mise-bas |
| Parvovirus + Erisipelas | 2 semaines après la mise-bas |
| Rhinite atrophique | 3 semaines avant la mise-bas |
| SDRPv | 60è jour de gestation + 6è jour de lactation |
| Escherichia coli + Clostridium perfringens | 2 semaines avant la mise-bas |
| Verrats | |
| Virus Aujeszky | 3 fois par an |
| Parvovirus + Erisipelas | 3 fois par an |
| Rhinite atrophique | 3 fois par an |
| Porcelets | |
| Mycoplasma hyopneumoniae | 7 + 21 jours de vie |
| Circovirus porcin type 2 | jour du sevrage |
Apparition du cas
On a détecté un érythème multiforme (EM) sur la plupart (90%) des truies, associé avec des problèmes respiratoires et sans mortalité. Depuis janvier 2014 jusqu’à notre visite clinique en mai 2014, quand on transférait les truies vers les cases où elles étaient logées en groupe (environ 30-35 jours de gestation), elles développaient un EM caractérisé par des zones cutanées surélevées et rouges réparties sur tout le corps, particulièrement sur le cou, la face et autour des yeux et des oreilles (figures 1-3). De plus, les truies malades présentaient de la dépression, de l’anorexie, une fièvre élevée pendant 1 à 3 jours (40-41,5°C), des difficultés posturales et des signes respiratoires (difficultés respiratoires modérées, écoulements oculaires et nasaux avec du mucus et du sang, figures 4-5). Ces symptômes n’apparaissaient pas sur les truies allaitantes ni sur les truies récemment sevrées ou dans le bâtiment des nullipares de renouvellement qui n’avaient pas encore été inséminées. Les signes cliniques étaient évidents et duraient plusieurs semaines sur la plupart des truies gestantes une fois mélangées dans les cases (environ 90%) ainsi que sur les truies et les nullipares du noyau des grand-parentales. D’autre part, 10 à 15% des truies et des nullipares avaient des retours juste après leur mélange dans les cases (tableau 2).
Tableau 2 : Paramètres de reproduction de l’élevage en 2014
| Paramètres de reproduction | Mois | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Taux de mises-bas (%) | 72 | 68,7 | 71,4 | 73,8 | 74,9 | 78,1 | 77,3 | 67,4 | 76,3 | 85,0 | 92,5 | 94,2 |
| Avortements (%) | 1,9 | 2,2 | 2,4 | 2,1 | 2,0 | 1,8 | 1,6 | 1,5 | 1,1 | 0,5 | 0,4 | 0,2 |
| Retours (%) | 26,0 | 29,0 | 26,0 | 24,0 | 23,0 | 20,0 | 21,0 | 31,0 | 22,5 | 14,4 | 7,0 | 5,5 |
| Truies vides (%) | 0,1 | 0,1 | 0,2 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Nés vivants/portée | 13,2 | 13,2 | 13,1 | 13,2 | 13,2 | 13,1 | 13,3 | 13,1 | 13,2 | 12,9 | 13,1 | 13,1 |
| Sevrés/truie | 10,7 | 10,9 | 10,8 | 10,8 | 10,9 | 11,0 | 11,1 | 11,1 | 11,2 | 11,4 | 11,6 | 11,8 |


Figures 1-2 : Truies malades logées en groupe avec de l’EM, caractérisé par des zones rouges et surélevées sur tout le corps
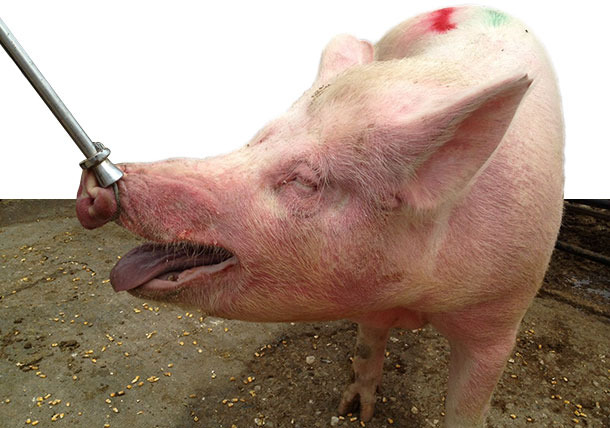
Figure 3 : Truies malades logées en groupe avec de l’EM, caractérisé par des zones rouges et surélevées sur le cou et la face (particulièrement autour des yeux et des oreilles).

Figures 4-5 : Truies malades avec de l’EM et avec dépression, anorexie, fièvre, difficultés respiratoires modérées, écoulements nasaux et oculaires avec du mucus et du sang.
Prélèvements et examen diagnostique
En mai 2014, on a prélevé des échantillons de sang de 7 truies malades ainsi que des écouvillons nasaux et vaginaux de quatre autres truies malades (les truies prélevées étaient à 30-45 jours de gestation et leur rang de mises-bas oscillait entre 1 et 5). De plus, en août 2014 on a prélevé des échantillons nasaux de 7 truies malades.
Les échantillons de sang ont été examinés par : a) PCR quantitative (qPCR) pour le SDRP (SDRP de type 1 ou européen et SDRP de type 2 ou nord-américain) et pour le PCV2, et b) ELISA pour les anticorps contre Actinobacillus pleuropneumoniae (App), Erysipelothrix rhusiopathiae (Ery), SDRP, Aujeszky gE (ADV), peste porcine africaine (PPav), peste porcine classique (PPCv), et Leptospira spp. On a examiné les écouvillons nasaux par PCR pour le gène apx-IV d’App, Bordetella bronchiseptica, Haemophilus parasuis, Pasteurella multocida, Streptococus suis, cytomegalovirus porcin (PCMv, Rhinite à corps d’inclusion) et grippe porcine (SIV) (H1N1, H3N2, H1N2).
On a aussi prélevé deux échantillons de sang (avec anticoagulant et avec une asepsie stricte et du matériel stérile) de truies malades pour leur culture sur sang. On a fait des analyses hématologiques et biochimiques des échantillons de sang. On a prélevé des échantillons de 7 truies malades à l’abattoir (peau, foie, rein et poumon) pour leur examen macro et microscopique.
On a aussi prélevé des échantillons d’aliment de toute la gestation et de la maternité pour recherche de mycotoxines (aflatoxines (B1, B2, G1, G2), deoxinivalenol (DΟN), acétyldeoxinivalenol (acétyl-DΟN), nivalenol, zéaralénone (ΖEΝ)] par la méthode HPLC (Varian 9010 & 9050).
Résultats de laboratoire
Les résultats d’ELISA et de PCR des échantillons de sang sont sur le tableau 3. Toutes les truies étaient positives en App et SDRP mais négatives en PPAv, PPCv, ADV et Leptospira spp. De plus, on n’a pas détecté de virémie par le SDRPv ni par le PCV2. Les résultats des écouvillons nasaux sont indiqués sur le tableau 4. On n’a pas détecté B. bronchiseptica, P. multocida ni PCMv dans aucun des échantillons. S. suis a été détecté sur tous les échantillons alors qu’un (n°11) a été positif en App, H. parasuis et S. suis. Un des échantillons prélevé en mai 2014 a été positif en SIV.
Tableau 3 : Résultats des analyses des prélèvements sériques de 7 truies qui présentaient des lésions cutanées et des symptômes respiratoires.
| Pathogènes | Test | Nb de porcs positifs/ Nb analysés | |
| Mai 2014 | Août 2014 | ||
| Actinobacillus pleuropneumoniae | APX-IV ELISA | 7/7 | 4/7 |
| Erysipelas | ELISA | 0/7 | 0/7 |
| Virus PPA | ELISA | 0/7 | 0/7 |
| Virus PPC | ELISA | 0/7 | 0/7 |
| PCV2 | qPCR | 0/7 | 0/7 |
| SDRPv* | ELISA | 7/7 | 7/7 |
| SDRPv type 1 (UE) | PCR | 0/7 | 0/7 |
| SDRPv type2 (EE.UU.) | PCR | 0/7 | 0/7 |
| Virus Aujeszky | gE Acs ELISA** | 0/7 | 0/7 |
| Leptospira spp. | ELISA | 0/7 | 0/7 |
*Résultats ELISA anticorps contre le SDRPv: < 0,4 négatif; 0,4-0,99 positif 1; 1,0-1,49 positif 2; 1,5-1,99 positif 3; 2,0-2,49 positif 4; 2,5-2,99 positif 5; ≥ 3,0 positif 6
** positif: infecté avec un virus de terrain (anticorps contre AK gE) - négatif: non infecté avec le virus de terrain (sans anticorps contre AK gE).
***L. Pomona, L. tarassovi, L. canicola, L. grippothyphosa, L. Bratislava: tous les échantillons < 1:100
Tableau 4. Résultats des PCR des écouvillons nasaux de truies malades.
| Nb de porcs positifs/ Nb analysés | Pathogènes | ||||||
| App | B. bronchiseptica | H. parasuis | P. multocida | PCMv | S. suis | SIV | |
| Mai 2014 | 1/4 | 0/4 | 1/4 | 0/4 | 0/4 | 4/4 | 1/4 (H1N1) |
| Août 2014 | 1/7 | 0/7 | 6/7 | 0/7 | 0/7 | 7/7 | 0/7 |
L’examen des écouvillons vaginaux a révélé des infections dues à E. coli et Streptococcus spp sur tous les échantillons. Sur les cultures de sang, on a isolé Streptococcus spp et Actinobacillus spp, alors que l’antibiogramme a montré qu’elles étaient sensibles à la pénicilline, l’ampicilline et la combinaison amoxicilline + acide clavulanique.
Les analyses hématologiques et biochimiques ont montré une leucocytose modérée avec des lymphocytes atypiques et une lymphopénie (probablement secondaire à la déplétion des lymphocytes CD4), une anémie légère et une thrombocytopénie dans un cas. Dans deux cas on a détecté un dénombrement d’éosinophiles supérieur à 3000/uL. Dans deux cas, un dénombrement total de globules blancs très élevé a été cohérent avec l’infection. L’examen histopathologique de la peau a montré une augmentation de la vascularisation du derme, principalement sur les couches superficielle et moyenne (figure 6). On n’a pas trouvé de lésions notables sur les autres organes analysés.
On n’a pas trouvé de mycotoxines dans les aliments de gestante et d’allaitante.
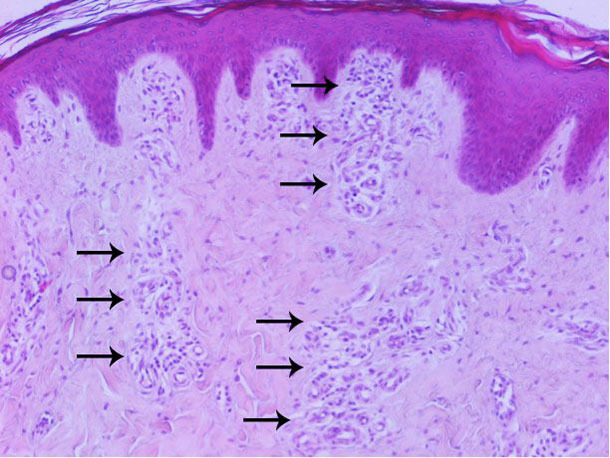
Figure 6 : Analyse histopathologique de la peau : augmentation de la vascularisation principalement sur le derme superficiel et moyen
Mesures prises
Pour combattre l’infection par E. coli et Streptococcus spp, en mai 2014 on a injecté de l’amoxicilline et de l’acide clavulanique à toutes les truies le jour du sevrage alors que, pendant la première semaine d’introduction des truies/nullipares dans la case où on les logeait en groupe, on leur a administré 400 ppm d’amoxicilline dans l’aliment. De plus, on a ajouté de l’aspirine en poudre dans l’aliment pendant 3 jours chez les truies malades. Enfin, pour diminuer l’agression entre les truies, on a appliqué un produit commercial (à base de plantes) au goût amer, sur la peau autour du cou et sur la partie supérieure du dos.
En août 2014, on a inclus la vaccination contre le SIV et contre H. parasuis dans le protocole vaccinal pour les truies et les nullipares et contre l’App dans celui des nullipares de renouvellement. Deux mois après le début des vaccinations, les signes cliniques (EM, signes respiratoires, etc. …) ont considérablement diminué.
Evolution du cas/Conclusions
Le stress affecte la fonction immunitaire, par conséquent les infections sont plus probables chez les porcs qui se trouvaient en situation stressante en logement en groupe. De plus, le stress peut provoquer l’activation d’une infection sub-clinique. Dans ce cas, il est possible que les truies/nullipares inséminées étaient sujettes à un stress au moment où leur statut immunitaire était plus faible, les rendant plus sensibles aux infections et au développement de maladies. On sait que les mélanges et une forte densité peuvent entraîner du stress, influençant négativement la fonction immunitaire. Comme l’EM est une réaction d’hypersensibilité qui est souvent déclenchée par les infections ou les maladies, l’explication possible de la manifestation clinique de l’EM dans ce cas pourrait être la fièvre (due aux infections par S. suis, H. parasuis et App) et probablement le stress (dû au mélange et aux bagarres). La possibilité d’inscrire l’infection par SIV dans l’étiologie est faible puisqu’elle ne s’est pas disséminée à d’autres truies et qu’elle ne devrait normalement pas affecter seulement les truies après le mélange en groupe.
Actuellement, après le contrôle initial des signes cliniques et la mise en place des vaccinations contre SIV et H. parasuis, on voit encore quelques cas sporadiques et très légers autant en nombre qu’en sévérité. Ces cas sporadiques se produisent essentiellement chez les nullipares après avoir été inséminées et mélangées en groupe (> 30-35ème jour de gestation). Le protocole de traitement comprend deux injections d’amoxicilline + acide clavulanique et du méloxicam/48 h. Alternativement on peut injecter deux fois de l’amoxicilline + acide clavulanique/48 h et ajouter de l’aspirine en poudre dans l’aliment pendant 3 jours.
En résumé, le stress pendant le logement en groupes peut être un facteur déclenchant dans ce cas clinique puisqu’il semble activer une infection subclinique ou une interaction avec différents pathogènes respiratoires, affectant négativement la santé et la performance des truies.







