Aujourd'hui, malgré les efforts documentés pour atteindre une fertilité et une prolificité acceptables après l'IA, la "cryosurvie" des spermatozoïdes porcins est encore faible, à cause des dommages produits pendant un procédé relativement ancien qui s'avère lent (8-9 h), cher (nécessité de centrifugeuses réfrigérées, etc.) et qui produit peu de doses par éjaculat (souvent seulement pour 5-8 truies avec 2 IA/chaleur). Le nombre de porcelets nés est encore plus faible qu'avec de la semence refroidie ou pure, impliquant que la vie utile des spermatozoïdes, l'emplacement de dépôt et la proximité de l'ovulation concourent au succès du procédé. Tout ceci fait que la semence congelée n'est pas une alternative dans la production porcine, bien qu'elle soit nécessaire pour les banques de gènes et l'exportation.
Cet article présente un procédé alternatif basé sur les caractéristiques in vivo de l'éjaculat, en utilisant la première portion de la fraction spermatique du verrat, juste 10 ml, pour congeler de petites doses (de 0.5 ml chacune), tandis que le reste des spermatozoïdes éjaculés (plus de 75%) sont utilisés pour la production courante de doses liquides, combinant ainsi la production et le stockage. La fertilité/prolificité de ces petites doses congelées/décongelées est acceptable si on utilise l'IA intra-utérine profonde lors d’une chaleur spontanée.

Ce que nous apprend l'éjaculat
L'éjaculat porcin est composé de 3 fractions qui peuvent visuellement se différencier pendant la récolte manuelle : fraction pré-spermatique (aqueuse, avec quelques caillots gélatineux, sans spermatozoïde et de quelques 10-20 ml), la fraction spermatique (plus dense, avec des spermatozoïdes, sans caillot, de 30-50 ml) et la post-spermatique (une autre fois aqueuse, avec des caillots et de 150-200 ml). Nos études ont montré que les spermatozoïdes contenus dans les 10 premiers ml de la fraction spermatique (appelée aussi pic spermatique, qui contient 15-20% de tous les spermatozoïdes, Fig 1) sont plus résistants à la manipulation (depuis la dilution jusqu'à la réfrigération) et à la cryoconservation que le reste des spermatozoïdes de l'éjaculat. On considère que le fait que les premiers spermatozoïdes soient accompagnés d'une sécrétion spécifique (épididyme/prostate), qui contient des protéines associées à la fertilité, explique la plus grande résistance au maniement.
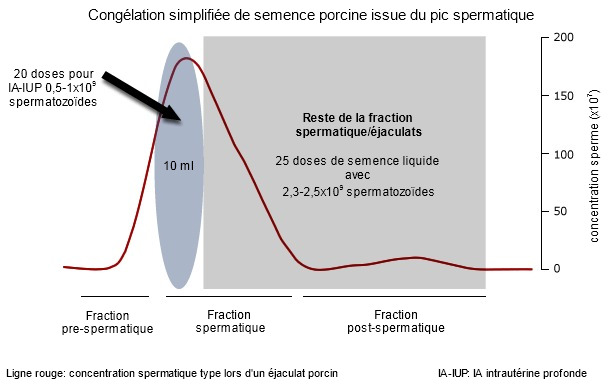
Figure 1 : Un éjaculat type de verrat présente 3 fractions différentes dépendant, parmi d'autres paramètres, de la concentration spermatique (représentée ici avec une ligne rouge). Le pic spermatique est généralement contenu dans les 10 premiers ml de la fraction spermatique. S'il est congelé, le pic spermatique peut produire 20 doses pour une IA intra-utérine profonde, tandis que le reste de l'éjaculat (la fraction spermatique) peut encore produire quelques 25 doses séminales liquides pour une IA conventionnelle.
Peut-on simplifier le protocole de congélation ?
Normalement la congélation utilise toute la fraction spermatique en éliminant le plasma séminal, par dilution et centrifugation dans des centrifugeuses refroidies. Les spermatozoïdes du dépôt sont alors dilués de nouveau, ils sont refroidis et sont souvent congelés sur des paillettes moyennes (2.5 ml) ou sur des Flat-bags de 5 ml (Fig 2). Les doses d'IA contiennent généralement 5.000x106 de spermatozoïdes, sachant qu'un éjaculat produit un maximum de 16 doses pour une IA cervicale (ou soit 8 truies à 2 IA/chaleur). On a comparé de la semence congelée de la fraction spermatique (témoin) avec celle du pic spermatique (les 10 premiers ml de la fraction spermatique) en utilisant une congélation conventionnelle (CC) contre un procédé simplifié (CS). La semence du pic spermatique a été concentrée (900x106 spermatozoïdes/dose) pour une utilisation éventuelle en IA intra-utérine profonde (1-2 doses par chaleur suffisent pour 10 truies). Les cellules du pic spermatique sont maintenues pendant 30 minutes dans leur plasma séminal et ensuite, sans centrifugation (c'est-à-dire, sans extraire le plasma séminal), sont diluées avec du lactose-crème d'œuf (LEY, initiales en anglais) et, pendant 1,5 h, sont refroidies jusqu'à atteindre + 5°C, avant d'être mélangées avec du LEY + glycérol (3%) et OEP (Orvus EST Paste, un détergent synthétique) et sont conditionnées en Mini Flat-bags de 0.5 ml (Fig 2). La congélation a utilisé dans tous les cas un taux de refroidissement de 50°C/min. Le processus simplifié complet (CS) a duré 3.5 h par rapport à la congélation conventionnelle (CC) qui a duré 8 h ; toutes les deux ont eu une cryoconservation également bonne (plus de 60% des cellules traitées).
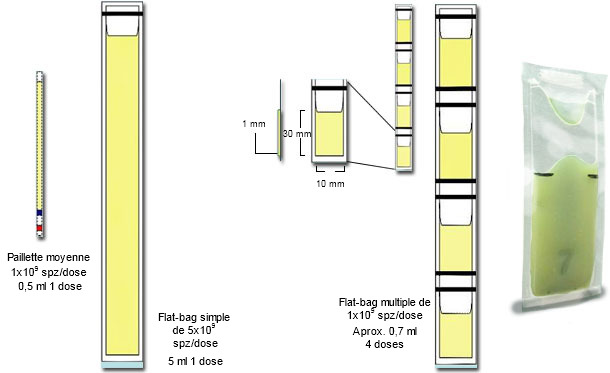
FFigure 2 : Représentation schématique des principales différences entre les mini-paillettes plastiques de 0.25 ml, avec des Flat-bags simples (5 ml) et multiples (de 0.5-0.7 ml). À droite on présente une photographie d'un Flat-bag rempli et scellé) . Cliché fourni par Dr Fernando Saravia).
Quels avantages a-t-il ?
Plusieurs : en utilisant ce protocole simplifié et plus court l'utilisation de centrifugeuses réfrigérées n'est pas nécessaire. D'autre part, la variation intra-mâles est diminuée en utilisant des spermatozoïdes de la première portion (P1) qui non seulement sont les "meilleurs" pour être cryoconservés en utilisant la partie de la fraction spermatique où il est bien documenté que l'on y trouve les protéines associées à la fertilité. Finalement, cette procédure libère le reste des spermatozoïdes récoltés (75-80% du total) pour un procédé supplémentaire de quelque 25 doses pour une IA conventionnelle (Fig 1). Ce protocole simplifié devrait être une alternative intéressante pour les centres d'insémination, en utilisant le même éjaculat, pour congeler la semence porcine pour le stockage, le repeuplement ou la distribution commerciale et produire des doses pour l'IA normale avec de la semence liquide, en utilisant le reste de l'éjaculat. Ce procédé n'interfère pas dans la routine de la conduite des verrats ni de leurs éjaculats.
Mais, ces doses si petites (0,5 ml, 500 x 106 spermatozoïdes) sont-elles fertiles ?

Oui, très fertiles, y compris après une seule IA intra-utérine profonde lors d'une chaleur spontanée. Les inséminations intra-utérines profondes doubles (à 24 et 36 h après la détection du reflexe d'immobilité) faites sur 120 truies (de seconde mise-bas) avec de la semence du pic spermatique congelé comme décrit plus haut (CS), ont produit 42 % de mises-bas avec 8 porcelets vivants par portée. Les doses complémentaires de semence liquide (2.3 x 109 spermatozoïdes) ont produit 80% de mises-bas, avec 13 porcelets vivants par portée (M Wallgren, résultats non publiés). Malgré que ce ne soit pas une alternative face à la semence liquide pour l'utilisation commerciale, cette technique de congélation est une bonne option pour les banques de gènes et les contrôles de biosécurité sans interférer dans la production de doses commerciales liquides ou dans la conduite des verrats.







