Le consortium européen de recherche sur le PCV2 a défini le terme global de “maladies associées au Circovirus porcin” pour englober les différents syndromes cliniques (dont fait partie la MAP), qui ont, au fil des ans et des investigations, été trouvés associés au PCV2. Ces maladies associées sont désignées par le sigle PCVD (pour Porcine Circovirus Associated Diseases). Ces affections sont nombreuses (voir aussi le chapitre 23).
Pathologie de la reproduction
Les expériences d’inoculation du PCV2 à des truies gestantes ont démontré que ce virus est capable de franchir la barrière placentaire à tous les stades de la gestation.
Au stade précoce, il provoque une mortalité embryonnaire élevée et une augmentation des retours en chaleurs.
En milieu de gestation, il se réplique de préférence dans les cellules du cœur des fœtus et cause donc des momifications ou des avortements.
En fin de gestation, ses cibles favorites sont les cellules du système immunitaire du porcelet, le cœur arrivant alors en 2ème position. Ces deux derniers cas s’accompagnent donc soit d’avortements tardifs, soit de naissances de portées à terme comptant un grand nombre de mort-nés, momifiés et/ou porcelets chétifs.
En Amérique du Nord comme en Europe, le PCV2 a été occasionnellement (mais de manière répétée) associé à des épisodes d’avortements tardifs et d’augmentation significative de la proportion de mort-nés. Ces cas sont pour l’essentiel décrits lorsque la majorité des mises-bas provient de cochettes (par exemple lors du peuplement de nouveaux élevages). Ils rentrent dans l’ordre au bout de quelques mois, mais le manque à gagner de production peut être très important.
Les critères de diagnostic de cette forme de maladie associée au PCV2 n’ont pas encore fait l’objet d’une définition au plan international. Celle-ci pourrait être :

|
1. avortements tardifs et mort-nés/momifiés, avec à l’autopsie une hypertrophie cardiaque chez les fœtus,
2. résultats négatifs de la recherche d’agents connus responsables d’avortements (virus de la maladie d’Aujeszky et du SDRP, parvovirus, leptospires…), 3. en histologie, présence de lésions cardiaques caractérisées par une myocardite fibrosante et nécrosante chez les fœtus, 4. présence d’une quantité élevée de PCV2 dans les lésions cardiaques (voire aussi d’autres tissus fœtaux). |
 |
 |
|
Poumon et myocarde (au centre) de fœtus infectés par voie intra-utérine par le PCV2. Le myocarde présente des zones de décoloration (nécrose) et une hypertrophie.
Photo transmise par le Dr. John A. Ellis, Université de Saskatchewan, Canada. |
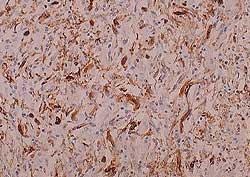
Myocarde d’un fœtus expulsé lors d’un épisode de trouble de la reproduction associé à l’infection par le PCV2. Noter la présence massive d’antigènes du PCV2 dans le myocarde (coloration marron). Immuno-histochimie.
Photo transmise par le Dr. John A. Ellis, Université de Saskatchewan, Canada. |
Dans une étude très récente, un élevage danois naisseur/engraisseur sans MAP ni avortement, mais avec un nombre important de mort-nés et de momifiés, est revenu au niveau de la moyenne nationale pour ces critères après la mise en œuvre de la vaccination contre le PCV2 sur les truies et cochettes.
Complexe respiratoire porcin (CRP)
Le complexe respiratoire porcin (CRP) est une entité clinique caractérisée par des troubles respiratoires, un retard de croissance, une augmentation de l’indice de consommation et une augmentation de la mortalité des porcs en post-sevrage et/ou engraissement.
De multiples agents infectieux ont été associés au CRP. Parmi eux :
|
- le virus du syndrome dysgénésique et respiratoire porcin (SDRP),
- le circovirus porcin de type 2 (PCV2), - le virus de la maladie d'Aujeszky, - le virus de l'influenza porcine, - le coronavirus respiratoire porcin, - Mycoplasma hyopneumoniae, - Actinobacillus pleuropneumoniae, - Pasteurella multocida, - Bordetella bronchiseptica, - Haemophilus parasuis, - Streptococcus suis. |
 |
Jusque récemment, le SDRP et Mycoplasma hyopneumoniæ étaient considérés comme les principaux agents responsables du CRP. Le PCV2 peut être ajouté à cette liste des principaux agents associés au CRP. Le PCV2 est aussi capable de provoquer des lésions pulmonaires qui ne peuvent, en général, pas être distinguées de celles induites par le SDRP ou d’autres virus. Cependant, en plus de la pneumonie interstitielle, le PCV2 est aussi associé à des lésions de bronchiolite fibreuse. |
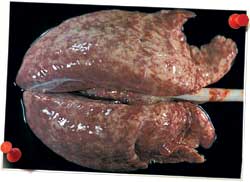
| Poumon d’un porc de 4 mois atteint de CRP. La forme lobulaire et l’absence de collapsus pulmonaire sont des indicateurs de pneumonie interstitielle. Cette découverte fait penser à une infection virale pulmonaire et/ou systémique. | |
 |
 |
|
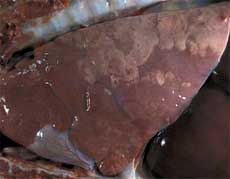
Poumon d’un porc de 3 mois atteint de CRP.
Consolidation pulmonaire cranioventrale marquée, signe d’une infection à mycoplasme, et/ou à d’autres bactéries à tropisme respiratoire. L’absence de collapsus pulmonaire est indicatrice d’une pneumonie interstitielle. |
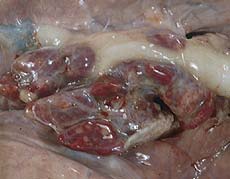
Poumon d’un porc de 4 mois atteint de CRP. |
Pneumonie proliférative nécrosante (PPN)
La pneumonie proliférative nécrosante (PPN) se caractérise par :
|
• la présence de cellules inflammatoires nécrotiques à l'intérieur des alvéoles,
• la présence de macrophages et de matière protéique dans les alvéoles, • une hyperplasie des cellules de la paroi des alvéoles pulmonaires (pneumocytes de type 2), • une bronchiolite nécrosante, • une augmentation fréquente de la taille des cloisons inter-alvéolaires due à l’accumulation de cellules inflammatoires mononuclées. |

 |
 |
|
Poumon d’un porc de 4 mois atteint de pneumonie proliférative nécrosante.
Noter la nécrose de l’épithélium bronchiolaire (flèche) et la présence de cellules nécrotiques dans les alvéoles (astérisques). Coloration HE. |
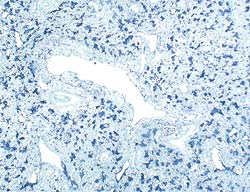
Poumon d’un porc de 4 mois atteint de pneumonie proliférative nécrosante.
Présence massive du génome du PVC2 (coloration bleue) Hybridation in situ. |
L’étiologie de la PPN n’a pas été clairement établie, mais dans un pourcentage très élevé de ces cas, cela correspond à une co-infection SDRP et PCV2.
Entérite granulomateuse
Cette diarrhée a été rapportée comme liée à la co-infection par le PCV2 et Lawsonia intracellularis, ou par le PCV2 et les cryptosporidies. Toutefois, plusieurs cas cliniques ont été récemment publiés, qui ne retrouvent que du PCV2 dans des élevages atteints d’une entérite sévère, voire hémorragique.
Nécrose d’oreilles
La nécrose d’oreilles survient chez des porcelets en post-sevrage. Elle concerne le bord externe du pavillon auriculaire. Les saignements qu’elle entraîne favorisent les morsures fréquentes par les congénères de ces porcelets et aboutissent à de véritables “amputations” en fin d’engraissement. Le PCV2 est fortement soupçonné dans l’origine de ces cas, souvent observés dans des élevages européens atteints de MAP. Toutefois, malgré des enquêtes rigoureuses, l’implication du PCV2 n’a pas pu être démontrée.
Adaptée à la situation française et actualisée par les Drs JB Herin,N. Bridoux et F. Joisel




