Les anticorps (Ab) ou immunoglobulines (Ig):
- lls sont produits par des lymphocytes B stimulés par des antigènes et différenciés dans des cellules plasmatiques (cellules sécrétrices d'anticorps, en anglais ASC: Antibody Secreting Cells)
- Sécrétés dans les fluides corporels extracellulaires.
- Capables de s'unir et d'attaquer les agents pathogènes étrangers, en les neutralisant et en les éliminant par de multiples mécanismes
Le monomère d'immunoglobuline a un poids moléculaire de 150-180 kDa et a une forme semblable à un Y (figure 1).

.
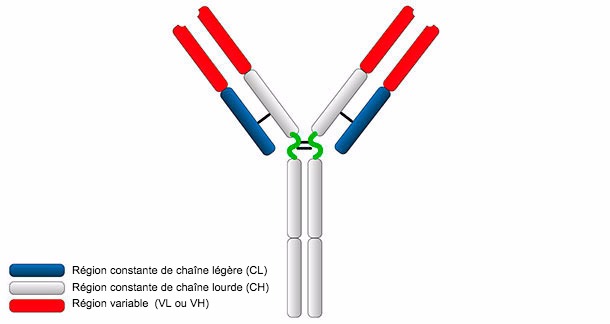
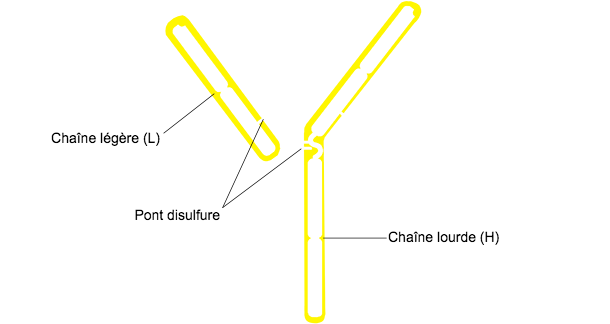
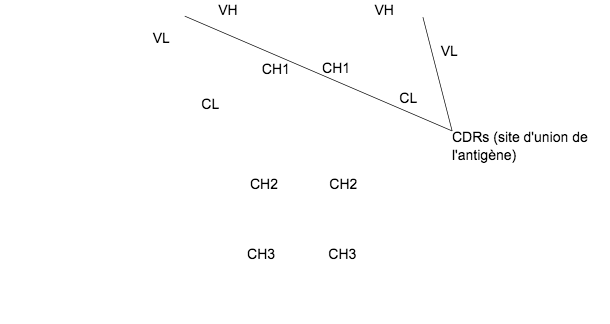
Figure 1. Structure générale d'une immunoglobuline
La structure typique d'une Ig se compose de deux chaînes lourdes (H: heavy) et de deux chaînes légères (L: light) unies par des ponts disulfure. Les deux chaînes se composent de deux parties, d'une région constante (C) et d'une région variable (V).
Les chaînes H et L ont des régions ou domaines où la protéine se plie pour former une zone globulaire, appelée VH, CH et VL, CL, respectivement. Les chaînes lourdes sont composées d'une partie variable (VH) et trois (pour les IgG et IgA) ou quatre (pour les IgM et IgE) domaines constants appelés CH1, CH2, CH3 et CH4. La chaîne légère peut être du type λ ou κ et est formée par deux domaines, un variable (VL ou VK) et un autre constant (CL ou CK). Les domaines VH et VL ont des régions très variables appelées CDRs (régions déterminantes de la complémentarité) qui sont le site d'union pour un antigène spécifique.
Il existe une région charnière entre CH1 et CH2 qui permet la flexibilité des molécules d'Ig. La digestion de cette région charnière avec des protéases aboutit à deux fragments Fab contenant le site de liaison à l'antigène et un Fc (fragment cristallisable) impliqué dans des fonctions de l'anticorps.
Les domaines CH2 et CH3 sont les sites de liaison pour les récepteurs Fc, tandis que les domaines CH1-CL s'unissent au fragment complémentaire C4b et le domaine CH2 se lie au facteur C1c du complément.
Une bactérie a différents épitopes de surface; au cours d'une infection, différents anticorps seront produits et chaque anticorps se liera à ses épitopes spécifiques sur le pathogène.
Les différentes séquences d'acides aminés de la région constante de la chaîne lourde caractérisent les différentes classes d'anticorps ou isotypes (Figure 2): IgD (chaîne lourde δ), IgM (chaîne lourde μ), IgG (chaîne lourde γ), IgA chaîne lourde α) et IgE (chaîne lourde ε). Les IgM sont sécrétées comme des pentamères et les IgA comme des dimères sécréteurs.

Figure 2. Les différentes séquences d'acides aminés de la région de la chaîne constante lourde (H) caractérisent différentes classes d'anticorps ou isotypes.
Certaines sous-classes d'Ig ont été décrites avec différentes chaînes lourdes, principalement entre les classes IgG et IgA.
Les différents anticorps sont les effecteurs de l'immunité humorale contre les agents infectieux et sont donc présents en concentrations élevées dans le sérum et dans d'autres fluides biologiques (sécrétions muqueuses, par ex. salive, lait, colostrum, etc.). Le rôle défensif des anticorps est dû à différents mécanismes (décrits dans la deuxième partie de l'article)

Les IgG sont des immunoglobulines ayant un poids moléculaire d'environ 108 kDa. Les immunoglobulines IgG sont plus nombreuses dans le sérum et dans les espaces extravasculaires. Les IgG sont principalement impliquées dans la réponse défensive systémique. Elles sont efficaces dans la neutralisation des virus, dans l'interaction avec la fraction C1 de complément et dans l'activation de la cascade du complément avec opsonisation et phagocytose des agents pathogènes. De plus, elles favorisent la mort des cellules infectées par des réactions de cytotoxicité cellulaire à médiation par anticorps (réactions ADCC -Antibody Dependent Cell-Mediated Cytotoxicity). Le porc possède six sous-classes d'IgG, d'IgG1 à IgG6.
Les monomères d'IgM ayant un poids moléculaire d'environ 108 kDa sont liés à la surface des cellules B et ont un rôle de BCR (Récepteur de Cellules B) pour la reconnaissance des antigènes. Les IgM sécrétées ont une forme de pentamère de forme circulaire dans laquelle cinq sous-unités de monomères sont liées par des liaisons disulfure et une chaîne J; cette forme penténétique a environ 900 kDa de poids moléculaire.
L'IgM est la première immunoglobuline synthétisée lorsqu'il y a un premier contact avec l'antigène. Elle est principalement sécrétée dans le cadre de la réponse immunitaire humorale primaire pour une première et importante défense contre les infections virales et bactériennes. La présence d'IgM spécifique contre un agent pathogène dans le sérum indique une infection récente / aiguë. Elles sont également sécrétées lors de la réponse secondaire, mais dans une moindre quantité. Dans cette forme, les régions Fc sont au centre avec dix sites de liaison à l'antigène à la périphérie. Les IgM peuvent se lier à plus de molécules du fragment C1 pour la voie classique et sont très efficaces dans l'activation du complément pour l'opsonisation , ainsi que dans la neutralisation et l'agglutination des virus.
Les anticorps IgM naturels (NA: "Anticorps Naturels" - IgM) sont produits par certains sous-ensembles de lymphocytes B qui peuvent être impliqués comme première ligne de défense contre la propagation systémique des agents infectieux.
L'IgA est la classe prédominante d'Ig dans les sécrétions (salive, mucus, larmes, colostrum, lait) sur les surfaces muqueuses et empêche la pénétration et la colonisation des pathogènes.
Les IgE sont des immunoglobulines d'environ 190 kDa de poids moléculaire et sont présentes à de faibles concentrations sanguines. Les immunoglobulines IgE sont spécifiquement impliquées dans l'hypersensibilité de type I et dans la défense contre les parasites.
Le monomère IgD joue un rôle principal en tant que BCR.