Prélèvements et demande d’analyses
Les prélèvements à effectuer en vue de confirmer une suspicion de MAP dépendent de l’objectif du vétérinaire.
 1 - Souhaite-t-il simplement confirmer ou écarter l'existence de MAP (diagnostic) ?
1 - Souhaite-t-il simplement confirmer ou écarter l'existence de MAP (diagnostic) ?
Dans ce cas, deux options s’offrent à lui. Il peut s’orienter vers une étude "minimaliste", auquel cas il ne prélèvera qu’une paire d’organes lymphoïdes (de préférence une paire de ganglions lymphatiques ou un ganglion lymphatique et une amygdale). Il peut aussi envisager une étude histopathologique relativement large (voir le tableau des prélèvements les plus appropriés).

|
Echantillons les plus appropriés pour la réalisation du diagnostic histopathologique de la MAP.
|
|
| Tissus | Caractéristique de l'échantillon* |
| Ganglions lymphatiques | Entiers (ganglions lymphatiques inguinaux superficiels, mésentériques, sous-mandibulaires et médiastinaux). |
| Amygdale | Entière. |
| Iléon | Coupe d'environ 10 cm de long et ouvert longitudinalement. |
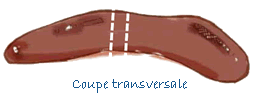
| Rate | Coupe transversale de 0,5 cm de large. |
| Thymus | Coupe transversale de 0,5 cm de large. |
| Poumon | Plusieurs coupes, incluant tous les lobes, touchés ou non (normalement : échantillons de lobe apical, lobe moyen et la partie craniale du lobe diaphragmatique). |
| Foie | Plusieurs coupes de 0,5 cm de large. |
| Rein | Coupe transversale de 0,5 cm de large. |
* Les échantillons sont fixés par immersion dans le formol à 10 %
Pour éviter des confusions, la demande à mentionner, lorsque l’on vise le premier objectif est celle de : « étude histopathologique et de détection du PCV2 dans les tissus ». Dans les deux cas, cela correspond à un diagnostic individuel.
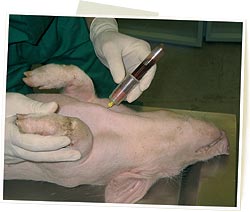
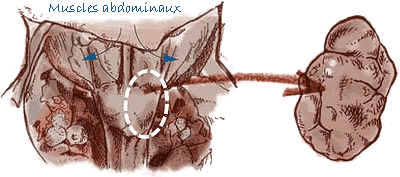 Prélèvement des ganglions lymphatiques |
||
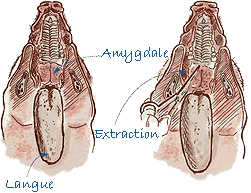 Prélèvement des amygdales |
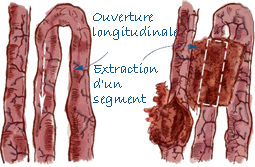 Prélèvement de l'iléon |
|
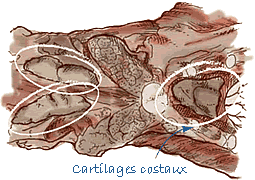 Prélèvement du thymus |
 Prélèvement de la rate |
|
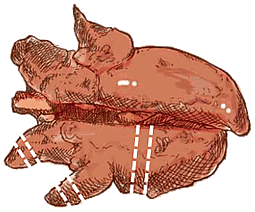 Prélèvement de poumon |
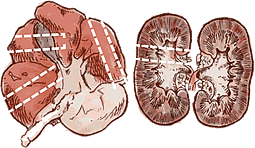 Prélèvement de foie et reins |
|
 |
|
|
2- Ou bien désire t-il valider l’existence de la MAP dans le cadre d’un cas clinique de l’élevage où, probablement, d’autres processus pathologiques existent (diagnostic global) ?
Pour ce deuxième objectif, le laboratoire d’analyses ne va pas limiter ses investigations à la MAP, mais envisager aussi toutes les maladies qui ont été incluses dans la liste de diagnostic différentiel, jointe au commémoratifs. Ainsi, il y a deux grandes options : 1. prélever ces échantillons, qui seront adressés au laboratoire d’analyses, 2. envoyer au laboratoire d’analyses des animaux entiers, représentatifs du problème clinique, en indiquant les diagnostics différentiels à confirmer ou écarter. Dans un tel cas, la demande à rédiger pour le laboratoire d’analyses sera plutôt : « étude anatomopathologique, histopathologique et microbiologique (bactériologique / virologique) des maladies comprises dans la liste de diagnostic différentiel ». |
  |
TRES IMPORTANT POUR LE DIAGNOSTIC :
Seront toujours adressés au laboratoire des échantillons de plusieurs animaux ou plusieurs animaux entiers en vue d’établir un diagnostic argumenté ; fournir des échantillons d’un seul animal ou un seul animal entier limite fortement les chances d’obtenir un diagnostic utile .
Les techniques de diagnostic de laboratoire : qu'est-ce qui est utile et qu'est-ce qui ne l’est pas ?
  |

De nombreuses techniques de détection du PCV2 ont été développées, que ce soit pour une mise en évidence à partir de tissus ou d’autres échantillons, ou pour la détection d’anticorps anti-PCV2.
Parmi les techniques mentionnées, il n’en existe aucune qui permette, à elle seule, de fonder un diagnostic définitif de MAP.
Au plan international, la technique de choix (“gold standard”) pour le diagnostic de laboratoire de la MAP est une combinaison de l’histopathologie et d’une technique de détection du PCV2 dans les tissus (immunohistochimie, qui met en évidence les antigènes du virus, ou hybridation in situ, qui en détecte le génome).
Ces techniques de détection du PCV2 permettent de corréler l’intensité des lésions lymphoïdes avec la quantité de virus présente.
| Techniques utilisées pour le diagnostic de la circovirose porcine et / ou la détection du PCV2 ou des anticorps face à ce virus | |
| Histopathologie | Permet de détecter les lésions microscopiques caractéristiques |
| Immuno-histochimie (IHC) | Permet de détecter l'antigène du PCV2 au sein des lésions microscopiques |
| Hybridation in situ (HIS) | Permet de détecter l'acide nucléique du PCV2 dans les lésions microscopiques |
| Immunofluorescence* | Permet de détecter l'antigène du PCV2 dans les tissus |
| Réaction de polymérase en chaîne conventionnelle (PCR) | Permet de détecter l’ADN du PCV2 dans les tissus, fluides biologiques ou écouvillons |
| PCR quantitative | Permet de détecter et quantifier l’ADN du PCV2 dans les tissus, fluides biologiques ou écouvillons |
| Isolement viral ** | Permet de détecter le PCV2 (virus viable) qui est isolé dans une culture cellulaire permissive |
| Immunoperoxydase sur monocouche de culture cellulaire (IPMA)* | Permet de détecter des anticorps contre le PCV2, permet leur titrage |
| ELISA | Permet de détecter des anticorps contre le PCV2 ; pourrait permettre le titrage sérique même si n’est généralement pas utilisé dans un objectif quantitatif |
*Techniques de laboratoire peu ou pas utilisées en routine
** N'est pas utilisé en routine, et de peu d'intérêt diagnostique depuis qu’il a été démontré que l’ADN nu du virus est infectieux une fois introduit dans un tissu permissif.
Plus l’intensité des lésions est importante, et plus la quantité de PCV2 présente dans ces lésions est importante.
 |
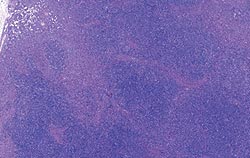 |
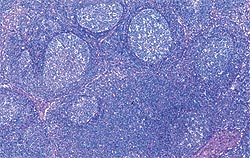
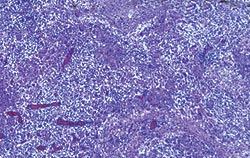
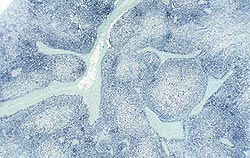
| Allure normale | Légère perturbation de l’architecture folliculaire |
 |
 |
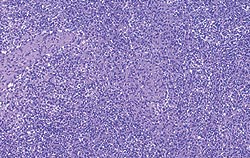
| Perturbation modérée de l’architecture folliculaire | Perturbation intense de l’architecture folliculaire |
|
Déplétion lymphocytaire et infiltration granulomateuse légères, modérées et intenses comparées à un ganglion de structure histologique normale. Les lésions modérées et intenses sont indicatrices de la MAP. Coloration HE.
|
La PCR est une technique très sensible, qui permet de détecter une très faible quantité d’ADN du PCV2. Dans sa version conventionnelle, c’est une technique qualitative (résultat positif ou négatif). Attention : un résultat positif en PCR peut correspondre à un porc malade aussi bien qu’à un porc infecté de façon sub-clinique. C’est pourquoi, la PCR conventionnelle n’est pas un outil fiable de diagnostic de la MAP.
 |
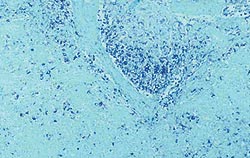 |
| Quantité modérée | |
 |
|
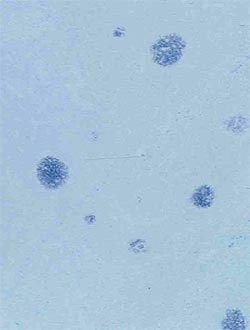
| Faible quantité | Quantité élevée |
|
Quantités faible, modérée et élevée de génome de PCV2 dans les organes lymphoïdes. Les deux images de droite correspondent à des cas de MAP. Technique d’hybridation in situ.
|
Le PCV2 est un virus ubiquiste : pratiquement 100 % des élevages sont infectés (et dans ceux-ci pratiquement tous les animaux le sont durant la phase de post-sevrage). Un porc donné peut être positif en PCR à un moment de sa vie, sans relation directe avec son état de santé. D’où la faible valeur diagnostique de la PCR conventionnelle vis-à-vis de la MAP.
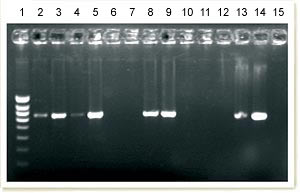
Gel issu de PCR conventionnelle pour la détection de l’ADN du PCV2. La colonne 1 correspond à l’échelle de poids moléculaire. On observe la présence d’ADN du PCV2 amplifié dans les colonnes 2, 3, 4, 5, 8, 9, 13 et 14. Les 13 et 14 correspondent aux porcs sains d’un élevage non atteint : ils fournissent une réponse de même intensité sur ce gel.
Ce qui montre que la PCR conventionnelle n’est pas une technique discriminante pour le diagnostic de la maladie.
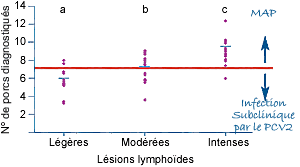
La PCR quantitative est un outil de diagnostic mieux adapté, puisqu’elle permet la quantification du génome du PCV2. Elle permet ainsi d’établir un seuil à partir duquel il peut être considéré qu’un animal présente de la MAP, et non plus une infection sub-clinique. Dans les faits, il y a bien une différence de virémie de 2 à 3 logs entre les sujets infectés et ceux cliniquement atteints. Ces différences se retrouvent lorsque l’on compare les virémies moyennes de lots d’animaux prélevés dans des élevages avec ou sans MAP clinique.
 |
Enfin, la sérologie est un outil qui permet de suivre l'infection du PCV2 dans une population. Cependant, le même problème que celui de la PCR reste posé : quand il n’existe pas de différentiel sérologique entre un porc atteint de MAP clinique et un porc infecté par le PCV2, cette technique manque de valeur diagnostique.
 |
Elevage A, atteint de MAP(1)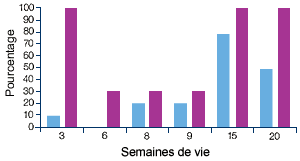 |
| (1) Profil sérologique (en violet) et profil PCR (en bleu) vis-à-vis du PCV2. Les manifestations cliniques ont commencé entre 10 et 12 semaines d’âge, ce qui correspond à une augmentation significative du nombre d’animaux infectés et à une séroconversion. |
Elevage B, atteint de MAP(2)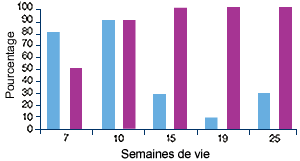 |
| (2) Profil sérologique (en violet) et profil PCR (en bleu) vis-à-vis du PCV2. Les manifestations cliniques ont commencé entre 7 et 10 semaines d’âge, ce qui correspond à une légère augmentation du nombre d’animaux infectés et à une séroconversion. |
Elevage C, indemne de MAP(3)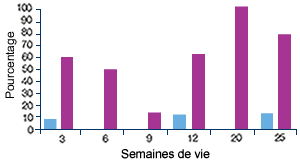 |
| (3) Profil sérologique (en violet) et profil PCR (en bleu) vis-à-vis du PCV2. Malgré l’absence de clinique, pratiquement tous les animaux séroconvertissent, ce qui indique une infection par le virus. |
Elevage D, indemne de MAP(4)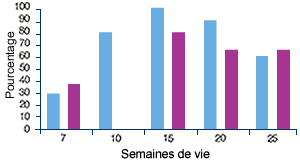 |
| (4) Profil sérologique (en violet) et profil PCR (en bleu) vis-à-vis du PCV2. Malgré l’absence de clinique, pratiquement tous les animaux séroconvertissent : ils ont été infectés par le PCV2. |
 |
Adaptée à la situation française et actualisée par les Drs JB Herin,N. Bridoux et F. Joisel



