Dans la production porcine moderne, Streptococcus suis est devenu une cause importante de prescription d'antimicrobiens. Avec une prévalence dans les élevages infectés proche de 100 %, il s'agit de l'un des pathogènes bactériens les plus importants chez les porcs et il représente un risque zoonotique, un coût économique significatif ainsi qu'un problème de bien-être animal. Ce défi est aggravé par le contrôle croissant des prescriptions vétérinaires et de l'utilisation des antimicrobiens, y compris les restrictions sur la métaphylaxie qui était utilisée jusqu'à présent pour contrôler l'apparition de la symptomatologie, mais pas la présence de S. suis.
Il existe au moins 33 sérotypes de Strep suis. Les sérotypes 2 et 9 sont les plus fréquemment impliqués dans les maladies et les épidémies. Leur virulence est particulièrement liée aux protéines mrp, epf, sly et à d'autres protéines, telles que luxS, qui sont impliquées dans la formation de biofilms et augmentent leur résistance au traitement et à la réponse immunitaire. Au sein de chaque sérotype, il existe une grande variabilité de la capsule bactérienne et des facteurs de virulence, ce qui complique la conception et l'efficacité des vaccins. Corsault et al. 2021 ont conclu que la vaccination des truies augmentait l'immunité maternelle transmise aux porcelets, étant maximale à 7 jours de vie, mais qu'elle diminuait considérablement au 18ème jour de vie et n'était pas en mesure de protéger les porcelets après le sevrage. Nous devons donc explorer d'autres outils de contrôle.

Le rôle du microbiote dans l'infection à Streptococcus suis
Dès 1996, il a été fait référence au contact précoce des porcelets avec S. suis pendant la mise bas, par contact avec les sécrétions vaginales. Il existe des études sur la manière dont la transmission d'un microbiote défavorable de la mère aux porcelets ainsi qu'une consommation/qualité insuffisante de colostrum affectent le développement de la maladie.
Une fonction essentielle du microbiote est d'empêcher la prolifération de pathogènes potentiels dans des conditions homéostatiques par des mécanismes de résistance à la colonisation : compétition pour les nutriments, production de composés antimicrobiens, ou indirectement en stimulant l'immunité innée et adaptative de l'hôte.
La modification du microbiote fécal de la truie a été corrélée à celle du microbiote vaginal et l'intervention au niveau du microbiote intestinal de la truie a conduit à une amélioration du microbiote vaginal avec une réduction des streptocoques au niveau génital. La présence d'une plus grande diversité de microbiote favorise la présence de populations bactériennes commensales qui entrent en compétition avec S. Suis pour l'espace et les nutriments, réduisant ainsi la pression d'infection et facilitant le contrôle de la maladie.
L'utilisation de solutions nutritionnelles qui améliorent le microbiote intestinal de la truie, influençant positivement la transmission verticale du microbiote au porcelet, conduirait à une meilleure capacité de réponse de l'animal contre la maladie.
Compte tenu de ces arguments, une étude de terrain a été réalisée dans une exploitation commerciale de 3 000 truies ayant des antécédents d'épidémies graves de S. suis qui ont nécessité un traitement antibiotique continu pour contrôler les symptômes. L'objectif était de mieux comprendre le mécanisme par lequel une combinaison spécifique d'acides gras à chaîne moyenne (AGCM) et d'acides gras à chaîne courte (AGCC) administrée dans l'alimentation des truies et des porcelets génère une amélioration du microbiote intestinal permettant une réduction de l'utilisation d'antibiotiques contre S. suis, comme nous l'avons observé.
Pour évaluer l'évolution du microbiote, des échantillons de fèces de truie ont été prélevés directement dans le rectum et des prélèvements d'amygdales ont été effectués sur un groupe de porcelets, qui ont été suivis depuis la maternité et tout au long de la période de post-sevrage, avant le début de la stratégie nutritionnelle et 4 mois après sa mise en place.
Les analyses suivantes ont été réalisées :
- Fèces (320 échantillons) : analyse des ratios de certaines populations bactériennes chez les mères (laboratoires Masterlab).
- Amygdales (176 échantillons) : analyse des sérotypes, des facteurs de virulence et du microbiote commensal, grâce à l'analyse d'autres Streptococcus spp (S. Hyovaginalis, S. Oralis, S. mitis (en collaboration avec le groupe de recherche BACRESP, Université de León).
Comment l'incorporation d’AGCC et d'AGCM a-t-elle affecté le microbiote ?
Au début de l'étude, les ratios bactériens dans les fèces des truies ont montré une grande variabilité dans toutes les phases de production (début, milieu et fin de la gestation et de la lactation). Les échantillons successifs prélevés toutes les 4 semaines sur les mêmes animaux pendant 4 mois ont montré une évolution vers la stabilité, des valeurs similaires étant détectées dans tous les échantillons à la fin de l'étude.
En raison d'une épidémie de grippe au milieu de l'étude, un traitement à l'amoxicilline a dû être effectué à partir de la deuxième semaine après le sevrage mais, malgré les complications liées à l'épidémie de grippe, il a été possible d'interrompre le traitement antibiotique chez les porcelets jusqu'à 10 jours après le sevrage, sans augmentation significative de la mortalité au cours de ces semaines.
Les résultats obtenus au niveau de l'amygdale chez les porcelets ont montré de nettes différences par rapport aux résultats initiaux en présence de traitements antibiotiques continus.
Dans le cas de S. suis :
- Avant le traitement nutritionnel : sa détection a augmenté progressivement avec le temps et la présence des facteurs de virulence gapdh et luxS a pu être détectée.
- Après traitement nutritionnel : le nombre d'échantillons avec la présence de S. suis isolé par culture a été réduit et est resté constant dans le temps au cours de l'échantillonnage. Lorsque nous avons pu caractériser les facteurs de virulence, ils étaient initialement positifs pour les gènes gapdh et luxS, mais n'avaient ensuite plus le gène gapdh. Un isolat était positif pour l'epf.
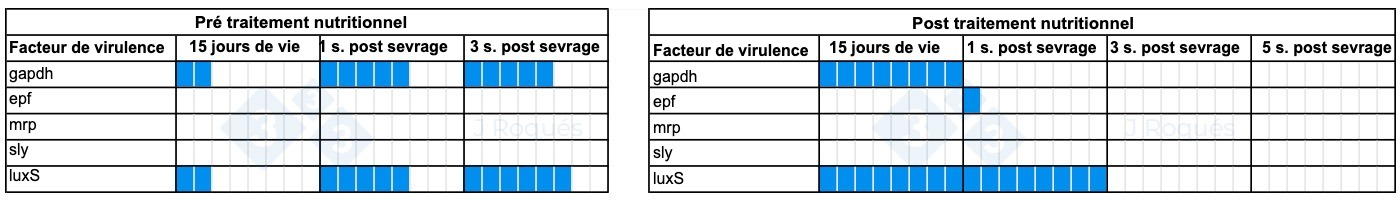
Tableau 1. Évolution des facteurs de virulence détectés chez Streptococcus suis après l'incorporation d'AGCC et d'AGCM.
Pour les bactéries commensales/environnementales :

- Avant l'ajout d'AGCM et d'AGCC : davantage de bactéries sont détectées à la fin de la période d'échantillonnage.
- Après l'ajout d'AGCM et d'AGCC : c'est le contraire qui se produit, les bactéries étant détectées au début de l'échantillonnage et n'étant pas trouvées au cours de la dernière semaine d'échantillonnage, probablement en raison de l'action du traitement antibiotique.

Tableau 2. Nombre d'échantillons positifs en culture avant et après l'incorporation d'ACGM et d'AGCC.



