Description du Senecavirus A
Le Senecavirus A (SVA auparavant connu sous le nom de virus Seneca Valley) est un virus ARN non enveloppé de 30 nm de diamètre. C’est l’unique membre du genre Senecavirus qui appartient à la famille des Picornaviridae.

Applications du SVA et implications pathologiques
Le SVA a été isolé sur des porcs depuis 1988 ; il a été décrit comme picornavirus-type jusqu’en 2002 quand on l’a isolé d’une culture cellulaire contaminée et il a été appelé virus Seneca Valley (Reddy, Burroughts et al. 2007). De fait, le SVA a été identifié comme virus non pathogène chez l’Homme avec des propriétés oncolytiques et on a évalué son efficacité comme thérapie contre le cancer dans des essais cliniques avec des humains (Rudin, Poirier et al. 2011). Le génome complet a été séquencé en 2008 (Hales, Knowles et al. 2008).
Les recherches sur le terrain vétérinaire ont montré que le SVA circule parmi les animaux domestiques au moins depuis la fin des années 80. On a détecté des anticorps contre le SVA chez les bovins, chez les rats et les porcs (Knowles, Hales et al. 2006). On l’a aussi présenté comme agent responsable de la maladie vésiculaire idiopathique (IVD) chez les porcs (Singh, Corner et al. 2012, Leme, Zotti et al. 2015). En résumé, l’Organisation Mondiale de Santé Animale (OIE) et la plupart des pays considèrent ces quatre maladies vésiculaires porcines comme étant à déclaration obligatoire : la fièvre aphteuse (Aphtovirus), la maladie vésiculaire porcine (Enterovirus), la stomatite vésiculeuse (Rhabdovirus) et l’exanthème vésiculeux porcin (Calicivirus). Les cas de maladies vésiculaires négatives vis-à-vis de ces 4 virus sont considérés «maladie vésiculaire idiopathique ».
Malgré plusieurs essais, on n’a pas encore pu reproduire expérimentalement la maladie vésiculaire à partir du SVA. Cependant, le virus a été démontré par hybridation in situ sur des lésions vésiculaires d’animaux atteints (figure 1). Actuellement on mène une étude pour essayer de reproduire la maladie vésiculaire avec un SVA récemment isolé dans le centre ouest des USA provenant de porcs ayant la maladie vésiculaire idiopathique.

Figure 1 : Biopsie cutanée d’une vésicule d’un port atteint. On détecte la présence de virus prédominant dans la couche épineuse de l’épiderme. Vésicule intra-épidermique : virus se répliquant dans les kératinocytes.
Association avec ETNL, Brésil et USA
Récemment (juillet 2015) le Brésil a signalé un nouveau syndrome associé au SVA. Le Dr. Vannucci, avec d’autres confrères, ont décrit un syndrome avec des pertes néonatales qui touche les porcelets de 0 à 7 jours de vie. Le taux de mortalité est plus élevé (40-80%) sur les porcelets de 0-3 jours et moindre (20-40%) sur ceux de 4-7 jours. Les portées de plus d’une semaine ne semblent pas être cliniquement affectées. Une fois la maladie déclarée, un syndrome d’amaigrissement conduisant à la mort commence relativement rapidement. Le taux de mortalité normal se rétablit en 4-10 jours. Il convient de signaler que la plupart des porcelets (> 80%) ont l’estomac rempli de lait/colostrum. A cause de ces caractéristiques, on a proposé le nom de mortalité néonatale épidémique transitoire (ETNL, les initiales en anglais) (Vannuci, Linhares et al. 2015) (figure 2).

Figure 2 : Caractéristiques aigües et transitoires de la mortalité néonatale épidémique transitoire (ETNL). A gauche : aspect typique d’une portée atteinte pendant un épisode d’ETNL. A droite : une nouvelle portée dans la même salle de mises-bas 10 jours après l’épisode de mortalité.

L’examen pathologique des porcelets atteints de plusieurs élevages du Brésil, et, ensuite du centre ouest des USA, n’a pas révélé de lésions macroscopiques ou histopathologiques courantes/constantes qui pourraient expliquer la cause de la mortalité. Une découverte constante dans les élevages avec de l’ETNL a été la détection de grandes quantités de Senecavirus A dans beaucoup de tissus des porcelets y compris dans le cerveau, le sang et les tissus lymphoïdes, ce qui montre une infection généralisée (Linhares, Rademacher et al. 2015) (figure 3). On n’a pas trouvé de SVA dans les tissus des porcelets non atteints.
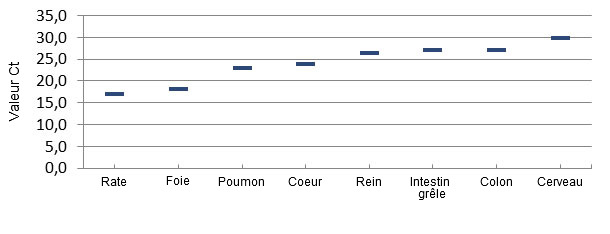
Figure 3 : Répartition du virus par PCR quantitative dans les tissus de porcelets atteints par ETNL.
Conjointement avec le syndrome ETNL, dans quelques élevages se produisent des cas de maladie vésiculaire idiopathiques avec des lésions modérées ou légères sur le museau et/ou les onglons (bandes coronaires, zone interdigitale ou les coussinets plantaires) (figure 4). Dans d’autres élevages, on n’a pas décrit de lésions de type vésiculaire indiquant que le SVA a besoin d’autres facteurs contribuant à établir la maladie (en supposant que le SVA cause la maladie). L’IVD qui accompagnait l’ETNL présentait aussi un caractère transitoire avec des lésions sur le nez qui guérissaient en quelques jours et celles des onglons en deux semaines.
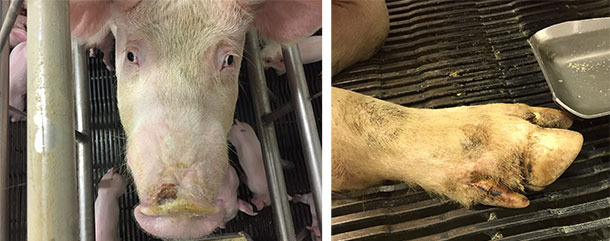
Figure 4 : Lésions sur le nez et les onglons dans les cas de maladie vésiculaire idiopathique.
Importance épidémiologique et implications
L’ETNL s’est disséminé rapidement au Brésil avec des épisodes groupés dans le temps et dans l’espace. En d’autres termes, quand on a décrit le syndrome dans un élevage spécifique, il était très probable que les élevages voisins en souffraient aussi, indépendamment du système de production, du flux des porcs/personnes ou de la source de génétique ou de nutrition. Il y a eu des exemples au Brésil et aux USA d’élevages fermés pendant plus de 6 mois (qui n’introduisaient ni de truies de renouvellement ni de verrats externes) qui ont eu de l’ETNL. Dans l’ensemble, ces observations suggèrent que l’ETNL et ou / l’IVD se transmettaient aussi par voies indirectes.
Jusqu’à présent, les premiers élevages qui ont rapporté des épisodes (septembre 2014) n’ont pas eu d’autres cas (que nous sachions). En d’autres termes, il semble que l’ETNL soit un « épisode unique », du moins depuis 1 an. En tenant compte que la plupart des élevages aient un taux de renouvellement d’environ 45%, tous les deux ans environ la plupart des truies ont été remplacées, par conséquent le rapport entre les animaux sensibles : immunisés/résistants peut changer significativement. Cela peut entraîner des vagues de cas d’ETNL tous les 1an ½ à deux ans.
Sachant que l’ETNL comme l’IVD sont dus à SVA, ce virus à un taux élevé de transmission (au niveau régional et de l’élevage), il est très immunogène et génère une immunité de longue durée (au moins 1 an).
Une étude récente d’épidémiologie moléculaire (Jianqiang et al. ASM science, acceptée ; Vannuci, Linhares et al 2015) a montré que les isolats contemporains de SVA (USA et Brésil, de cas d’ETNL et/ou IVD) se regroupaient séparément de la plupart des isolats historiques de SVA, montrant qua SVA pourrait avoir changé récemment et augmenté sa pathogénicité. Une autre possibilité est que l’augmentation récente de cas cliniques associés avec le SVA pourrait être due à des changements (augmentation) du taux de transmission et/ou de survie dans l’environnement de SVA.
On doit encore comprendre comment et où se « cache » le SVA entre les épisodes et comment il se transmet entre élevages. En d’autres termes, est-ce que le SVA peut rester infectieux dans les ingrédients des aliments ? Peut-il être transporté par l’air, par les vecteurs ? On a encore besoin de beaucoup d plus de recherches pour répondre à ces questions.
En avançant
Divers travaux de recherche sont menés pour aborder des thèmes comme a) développer/valider un test ELISA pour le SVA, b) confirmer le rôle du SVA dans l’ETNL/IVD, c) comprendre l’épidémiologie moléculaire du SVA au Brésil et aux USA, d) mettre au point des protocoles de désinfection contre le SVA.
On doit effectuer une recherche contre les maladies exotiques dans chaque cas d’IVD détecté pour écarter les 4 autres maladies vésiculaires (y compris la fièvre aphteuse).
Remerciements
Dr. David Barcellos, de l’Université de l’Etat de l’Iowa et l’équipe de recherche et d’extension de l’Université du Minesota



