Description de l'élevage
Il s'agit d'un élevage de multiplication de 250 truies, situé dans la région polonaise de Grande-Pologne, où toutes les truies qui serviront pour le renouvellement restent jusqu'à ce qu'elles atteignent les 100 kg. Les mâles et les cochettes écartés sont vendus à un engraisseur après le sevrage. On utilise l'insémination artificielle. On travaille en groupes technologiques de 10 truies gestantes et les porcelets sont sevrés à 28 jours, en utilisant le système en tout plein-tout vide. On sèvre environ 6200 porcelets chaque année.

Au moment de l'apparition du cas les conditions ambiantes de l'élevage étaient bonnes et le statut sanitaire était très élevé : il était négatif en Brachyspira hyodysenteriae, Salmonella spp. et Pasteurella multocida toxinégique, SDRP, Actinobacillus pleuropneumoniae, Mycoplasma hyopneumoniae, Leptospira spp. et seulement positif en Bordetella bronchiseptica et Lawsonia intracellularis. Il n'y a pas eu non plus de cas de MAP de décrit. Le plan prophylactique des truies reproductices comprenait la vaccination contre la colibacillose (sur les nullipares à 8 et 3 semaines avant la mise-bas et sur les truies à 3 semaines) et contre le rouget et la parvovirose (sur les nullipares à 5,5 et 6,5 mois d'âge et sur les truies à 3 semaines avant mise-bas). On ne vaccinait pas contre le PCV2.
Apparition du cas
Pendant la première visite on a observé une mort subite des animaux, on a aussi observé des animaux avec un abondant œdème facial, sur les oreilles et en région pectorale (fig. 1), ainsi qu'une augmentation de la température corporelle jusqu'à 41,5 ºC. Sur quelques animaux on a aussi observé des symptômes neurologiques (opisthotonos, position latérale, des mouvements de pédalage au niveau des pattes). Au départ on a observé les symptômes dans un groupe de nullipares de 70 à 100 kg de poids. La morbidité a augmenté jusqu'à plus de 15 % et la mortalité est montée jusqu'à plus de 6 %. Pendant le mois suivant on a observé des symptômes similaires, mais avec une intensité légèrement plus faible et qui ont touché de plus jeunes animaux – en post-sevrage et des nullipares jusqu'à 70 kg. Au cours des semaines suivantes, on a observé les mêmes symptômes (excepté les symptômes neurologiques) sur des truies sevrées, en maternité et en lactation.
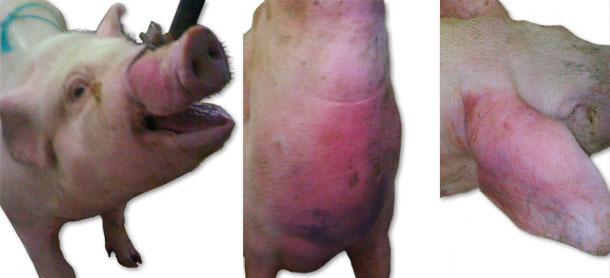
Fig. 1. Symptômes d'oedème
Autopsies et analyses de laboratoire
On a envoyé 4 animaux malades au laboratoire. Ils montraient des symptômes cliniques comme un important œdème avec signe du godet sur les parties les plus basses, une accumulation sous-cutanée de liquide dans la région du sternum sur deux porcelets sevrés (fig. 3) et une température de 41,0 à 41,3 ºC. L'autopsie a montré une infiltration sous-cutanée gélatineuse, spécialement dans les zones les plus basses (fig. 2, 3), des péricardites séro fibrineuses (fig. 4) et de la pleurésie.
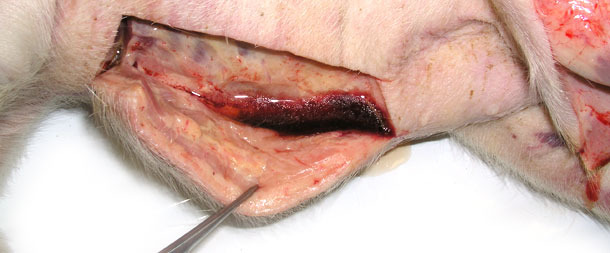
Fig. 2. Gonflement du tissu sous-cutané, une grande quantité de fluide s'écoule après une incision de la peau dans la zone basse du corps.
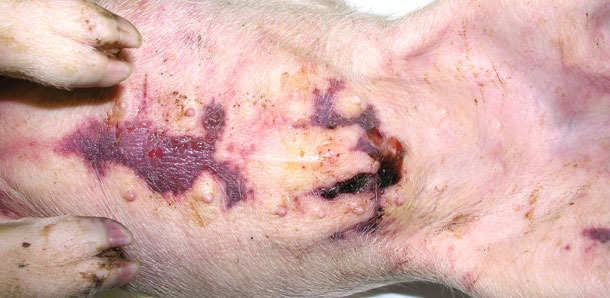
Fig. 3. Accumulation de liquide sous la peau dans la région sternale.
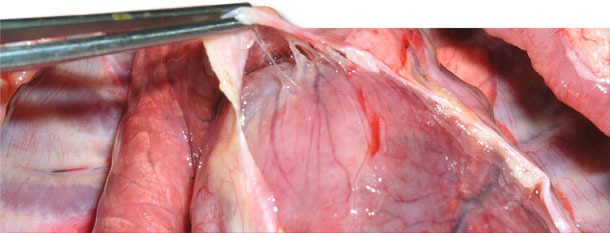

Fig. 4. Fibrine entre l'épicarde et le sac péricardique.
Après l'estimation pathologique, on e effectué l'examen bactériologique. Puisqu'il n'y avait pas de boiteries ni de symptômes nerveux sur les animaux examinés, on n'a pas prélevé d'échantillons des articulations ni de liquide cérébro-spinal. Le matériel analysé a été aseptiquement recueilli et les écouvillons ont été prélevés peu après l'ouverture des cavités corporelles.
On a ensemencé les échantillons sur de la gélose avec 5 % de sang de cheval avec un ensemencement de Staphylococcus epidermidis et sur de la gélose McConkey. Les boîtes ont incubé pendant 24 à 48 heures à 37ºC ± 2 ºC, CO2 8 % (± 2 %) et l'augmentation des colonies a été visuellement inspectée, avec une coloration de Gram et au microscope. L'identification a été réalisée par des tests biochimiques (Vitec) ou par PCR.
Résultats de laboratoire
Les études bactériologiques ont seulement montré une croissance d’Haemophilus parasuis (H. parasuis). Les colonies étaient très petites (comme des piqûres d'épingle), non hémolytiques, avec satellitisme (augmentation des colonies) autour de la strie de Staphylococcus epidermidis (source de NAD).
Les écouvillons prélevés au cours des changements pathologiques (porcelets sevrés) ont été analysés par PCR. Les résultats sont indiqués sur le tableau 1.
Tableau 1. Résultats d'isolementt d'Haemophilus parasuis des organes, du tissu sous-cutané et du sang analysé.
| tissu | porcelet 1 | porcelet 2 | porcelet 3 | porcelet 4 |
| Isolement + PCR / PCR tissu | ||||
| plèvre | +/+ | +/+ | +/+ | +/+ |
| péricarde | +/+ | +/+ | +/+ | +/+ |
| péritoine | -/- | +/+ | -/- | -/- |
| sérum | +/+ | -/- | -/- | -/+ |
On a confirmé la présence d'H. parasuis dans les lésions typiques de la maladie de Glässer. On a aussi identifié la bactérie, ou son ADN (PCR), sur sérum ce qui a démontré que deux des quatre porcelets analysés présentaient une bactériémie.
Après la détection de H. parasuis sur les 4 porcelets autopsiés, on a prélevé 20 écouvillons nasaux des porcelets sevrés, des nullipares et des truies pour comparer les souches des animaux malades à ceux des animaux sains (porteurs). On a réalisé un isolement et une identification des micro-organismes des écouvillons (identification biochimique et confirmation finale de la souche par PCR).
On a analysé dix isolats d'H. parasuis – quatre des animaux autopsiés et six des animaux sains – grâce à une caractérisation moléculaire par ERIC PCR (fig. 5). Tous les isolats obtenus des animaux malades avaient le même profil ERIC PCR. Curieusement, on a trouvé des souches identiques dans les échantillons nasaux de deux des six animaux sains. Les quatre restants avaient des souches différentes de H. parasuis dans la cavité nasale, caractérisés par des profils ERIC PCR différent.
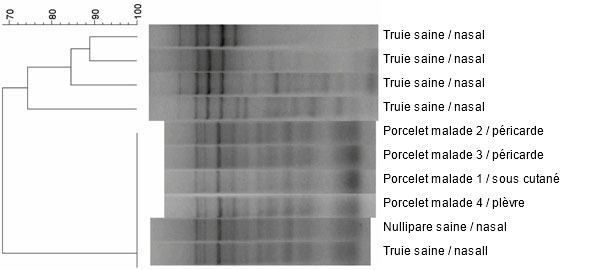
Fig. 5. Dendrogrammeque comparant les souches isolées d'H. parasuis par ERIC PCR.
Traitement
Le traitement a été de l'amoxicilline et de l'acide clavulanique sur les animaux avec des symptômes cliniques et la mise en place d'un traitement métaphylactique avec de l'amoxicilline dans l'eau de boisson (14 jours, 20 mg/kg de PV) sur le reste des animaux. Ce traitement a eu un résultat thérapeutique permanent.
Conclusions
Dans les exploitations avec un statut sanitaire élevé, l'infection par H. parasuis se présente souvent sous forme aigüe, touchant des animaux de tout groupe d'âge. Les symptômes comme la fièvre, l'apathie, les problèmes respiratoires, la douleur à la pression des muscles abdominaux (défense musculaire), l'inflammation des articulations et les boiteries, sont caractéristiques de cette forme de maladie de Glässer. On peut aussi observer des symptômes nerveux et un œdème sous-cutané, comme ce qui s'est passé dans ce cas.
Les changements pathologiques décrits dans ce cas sont caractéristiques d'une inflammation aigüe sérofibrineuse. Ces changements ne sont pas pathognomoniques, car le diagnostic doit être basé sur l'analyse de laboratoire.
La spécificité de la localisation de l'œdème dans les parties basses du corps ainsi que son caractère dépressible fait penser à un trouble cardiaque (œdème cardiaque), concrètement un trouble cardiaque congestif avec la stagnation de sang résultant dans la circulation systémique. Cependant, cette conclusion ne concorde pas avec la présence confirmée d'H. parasuis dans le tissu sous-cutané de ce cas concret. Cela pourrait suggérer un gonflement inflammatoire dû directement par l'agent bactérien. Cela peut être expliqué par la bactériémie : on a détecté la présence de la bactérie dans le tissu sous-cutané, originaire de vaisseaux sanguins endommagés.
La possibilité de différencier des souches d'H. parasuis circulant dans l'élevage peut être importante puisque l'épidémiologie d'H. parasuis est complexe et l'infection qu'il entraîne est un processus dynamique. Pour cela on utilise souvent différentes techniques de typage ce qui permet de différencierr différentes espèces (ERIC PCR). Dans des élevages à bon statut sanitaire, certaines souches pouvant entraîner la maladie prédominent. Dans le cas décrit on a démontré que six isolats avaient le même profil ERIC PCR et appartenaient à la même souche pathogène d'H. parasuis. On a aussi confirmé sa présence sur des animaux cliniquement sains. Ce fait et l'effet thérapeutique permanent de l'antibiotique (sans vaccination) pourraient indiquer une immunité croissante dans l'élevage contre de nouveaux cas cliniques induits par la même souche pathogène.