L'interaction entre Mycoplasma hyopneumoniae et son hôte le transforme en l'un des principaux contributeurs de la maladie respiratoire porcine. Il est transmis par contact direct, particulièrement chez des porcs de plus de 6 semaines, mais la transmission verticale se produit aussi des truies/primipares aux porcelets.
L'infection par M. hyopneumoniae se produit quand la bactérie attaque l'épithélium ciliaire qui couvre les voies aériennes. L'adhésion se traduit par des groupements ciliaires, la ciliostase et la mort des cellules épithéliales ciliées atteintes. Les dommages de l'épithélium cilié interrompent la fonction de l'appareil muco-ciliaire (en neutralisant l'élimination de pathogènes et de particules de poussière des voies respiratoires) et l'expansion du tissu lymphoïde associé aux bronches (BALT).

Ces lésions contribuent à de la toux non productive qui est observée dans les infections par M. hyopneumoniae et à une augmentation de la sensibilité à d'autres pathogènes du tractus respiratoire. Le temps passé entre l'infection par M. hyopneumoniae et l'apparition de symptômes cliniques (plus fréquents chez des porcs de 7-12 semaines d'âge) dépend de la dose et de la souche de M. hyopneumoniae, de l'état immunitaire et des stratégies de conduite.
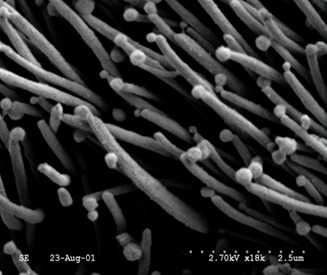
Image 1. Microscopie électronique de bactéries de Mycoplasma hyopneumoniae adhérant aux cellules épithéliales ciliées du tractus respiratoire porcin. Source : Dr. Carlos Pijoan.
La pneumonie peut déjà se détecter à partir de la première semaine après l'infection par M. hyopneumoniae, elle atteint son pic à 3-4 des semaines et le pourcentage de poumons touchés diminue généralement à 5 semaines post-infection. L'évolution de la pneumonie coïncide avec la réponse immunitaire anti-M. hyopneumoniae. Le schéma moléculaire de la bactérie et les signaux produits par les cellules ciliées alertent le système immunitaire. Les neutrophiles infiltrent les zones péri-bronchiolaires et péri-vasculaires du poumon au bout d'une semaine d'infection et les macrophages s'infiltrent une semaine après.
Les neutrophiles comme les macrophages sécrètent des cytokines pro-inflammatoires, qui à leur tour augmentent la réaction inflammatoire et attirent les cellules lymphoïdes vers la zone d'infection.
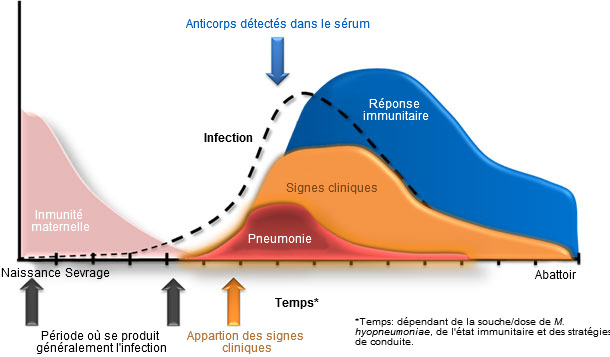
Figure 1. Dynamique d'infection par Mycoplasma hyopneumoniae, signes cliniques et réponse de l'hôte. Les zones de différentes couleurs et les flèches correspondent aux différents composants de l'infection et de la maladie. Toute la période est dépendante de la dose/souche de M hyopneumoniae, de l'état immunitaire et de la conduite.
Les lymphocytes apparaissent dans des zones pulmonaires atteintes autour des 2 semaines post-infection. La présence, autant des lymphocytes T que des B dans la zone d'infection est importante pour l'élimination de M. hyopneumoniae. Les lymphocytes T sont vitaux pour activer la production des IgA et des IgB pour les lymphocytes B. Les IgA peuvent neutraliser la capacité de M. hyopneumoniae à attaquer les cellules de l'épithélium cilié. Il est probable que les IgG soient importantes pour augmenter la phagocytose bactérienne. Les IgA et les IgG peuvent déjà se trouver dans le poumon peu après l'arrivée des lymphocytes ; cependant l'apparition dans le sang d'anticorps spécifiques contre M. hyopneumoniae peut aller jusqu'à 6 semaines. Les lymphocytes T sont aussi importants car ils stimulent les macrophages en augmentant leur efficacité en tuant les bactéries qu’ils ont phagocytées. On a aussi démontré que les lymphocytes T dans le sang répondent directement à M. hyopneumoniae : ils prolifèrent et produisent des IFNg en les exposant in vitro à l'antigène M. hyopneumoniae.
M. hyopneunomiae module aussi le système immunitaire du porc. M. hyopneumoniae a démontré qu'il a des propriétés mitogéniques et stimule la production de cytokines pro-inflammatoires. La présence de cellules immunitaires et de leurs protéines immuno-modulatrices forme un milieu pro-inflammatoire qui stimule la formation du centre germinal et l'expansion du BALT. Bien qu'un BALT mûr peut être efficace pour identifier et combattre les pathogènes, il peut aussi servir de réservoir de cellules capable d'être infectées par des pathogènes (par exemple, les macrophages alvéolaires qui peuvent être infectés par le SDRP).
Dans les exploitations bien gérées, M. hyopneumoniae peut avoir une importance relativement faible ; cependant, en présence d'autres pathogènes respiratoires, M. hyopneumoniae peut préparer le terrain pour des infections complexes.
Les traitements antibiotiques éliminent souvent l'infection et bien que la prévention vaccinale soit bénéfique pour l'évolution de la maladie, particulièrement dans les infections complexes, les vaccins ne préviennent pas l'infection par M. hyopneumoniae. Les infections des truies se produisent souvent avec l'introduction d'autres animaux de renouvellement infectés, cependant, la plupart des truies transmettront l'infection seulement à une portée puisqu'elles auront éliminé leur infection et développé une contre M. hyopneumoniae quand arrive leur mise-bas suivante. L'immunité spécifique face à M. hyopneumoniae est transférée aux porcelets par le colostrum/lait et on a démontré qu'elle est, au moins, partiellement protectrice sur ces porcelets. L'immunité maternelle peut contribuer à retarder l'apparition des signes cliniques chez les jeunes porcs.
L'impact économique de M. hyopneumoniae est très influencé par les pratiques de conduite et par les conditions de l'élevage. La diminution du GMQ se produit à partir d'affections pulmonaires de 10-20%; cependant, il est possible que le niveau d'infection par M. hyopneumoniae ne se reflète pas de façon consistante dans les performances des animaux. Les bâtiments avec beaucoup de poussières et une faible ventilation, peu d'hygiène ou d’autres facteurs de stress, peuvent enregistrer plus rapidement des effets sur les performances des animaux.