L’incidence et l’impact de l’infection par le circovirus porcin de type 2 (PCV2) et ses pathologies associées (PCVAD, anciennement la MAP) ont changé considérablement sur les 15-20 dernières années. Avant 2004, le PCV2 avait une forte prévalence sur la population porcine mais était souvent asymptomatique, par conséquent on n’avait pas beaucoup confiance dans le diagnostic des maladies associées à cet agent. La définition clinique et les critères diagnostiques du syndrome d’amaigrissement du porcelet (MAP, actuellement PCVAD) ont été reconnus par Sorden en 2000 (figure 1) et ont été largement acceptés par la communauté vétérinaire puisque la maladie s’est propagée de par le monde, pouvant les renforcer dans la pratique. Sorden a introduit, sagement, les signes cliniques typiques, les lésions typiques et la mise en évidence du virus dans la définition clinique et dans les critères de diagnostics.

Figure 1 : MAP Définition clinique. Sorden, Swine Health Prod 8(3):133-136, 2000
Le diagnostic d'un porc ou d'un groupe de porcs comprend :

Pendant la phase épidémique (2004-2007), les mortalités par le PCVAD en engraissement atteignaient 40% produisant une chute de la commercialisation de presque 10% aux USA. Au début de 2006, les producteurs demandaient désespérément une mesure efficace. Bien que plusieurs groupes de chercheurs travaillaient sur le développement d’un vaccin commercial depuis la fin des années 1990, aux USA on ne commercialisa rien jusqu’en 2006 et ce n’a été complètement disponible qu’en 2007-2008. Les vaccins commerciaux ont démontré être considérablement efficaces autant dans la prévention des pertes désastreuses dues aux morts et à l’amaigrissement que sur l’augmentation des performances globale et sur la diminution de la variation du gain du poids. L’application réussie des vaccins commerciaux s’est poursuivie jusqu’à ce jour ; sur la figure 2 on montre l'évolution du nombre de diagnostics dans le laboratoire de diagnostic vétérinaire de l'université d'Iowa (ISU VDL).
Figure 2 : Fréquence relative du diagnostic du PCVAD (ISU VDL)
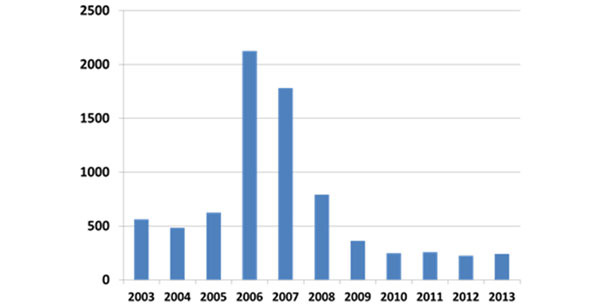
Les vaccins sont encore efficaces contre la PCVAD et presque tous les animaux produits commercialement aux USA sont vaccinés mais comme le PCV2 continue à circuler dans les populations vaccinées, il apparaît encore quelques cas de PCVAD.
Outils de diagnostics et variation du PCV2
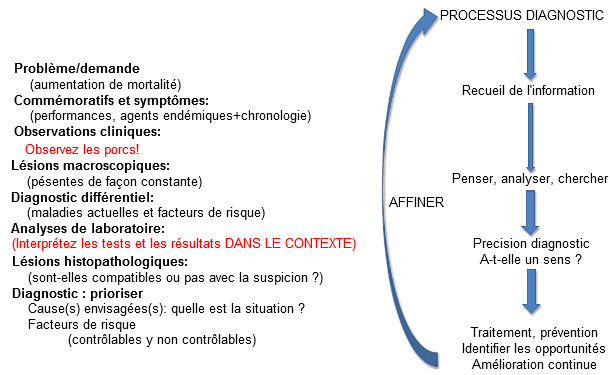
Les tests de diagnostic sont des outils qui peuvent être utilisés par les professionnels formés et expérimentés en les interprétant dans le contexte du scénario clinique et des découvertes macro-et microscopiques. La confiance dans l'exactitude d'un diagnostic demande que tous les éléments « s’alignent », c'est-à-dire, qu’ils soient précis et expliquent une histoire cohérente. Les observations ou les résultats des tests qui n'ont pas de sens doivent entraîner une réévaluation immédiate du processus diagnostique (figure 3). C'est un concept très simple, mais dans la pratique il peut être négligé. Les suppositions, les biais dans les confirmations et la prise en compte superficielle des options diagnostiques peuvent conduire à (et souvent y mènent) des diagnostics erronés.
Figure 3 : « Alignement » diagnostic : Toute l'information doit avoir du sens.
Les principaux outils de diagnostic contre le PCVAD sont :
- L’histopathologie avec détection de l’antigène ou de l’agent sur des échantillons de tissus (immunohistochimie, hybridation in situ)
- Détection génomique (PCR) et caractérisation (séquençage) avec des techniques moléculaires.
L’immunohistochimie est une excellente méthode pour mettre en évidence l’antigène viral sur des échantillons de tissus avec lésions. Cependant, l’IHC n’est pas particulièrement sensible pour détecter la présence de virus et de plus, elle a une interprétation subjective. Des résultats divergents peuvent, et sont, émis. L'IHC doit être menée à bien par des pathologistes bien formés et, quand il n'y a pas « d’alignement » du diagnostic, elle doit être réexaminée.
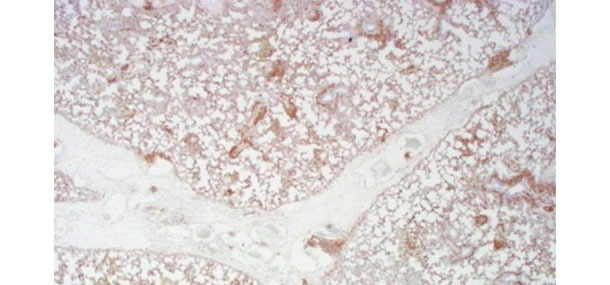
Coloration positive (marron) pour le PCV2 par immunohistochimie sur un poumon de porc
avec œdème inter lobulaire grave et pneumonie interstitielle diffuse
La réaction en chaîne de la polymérase (PCR) est indubitablement la méthode la plus sensible pour la détection de gènes spécifiques. Une PCR positive NE confirme PAS la cause de la maladie, elle répond simplement à la question : Y-at-il du PCV2 dans l’échantillon analysé ?
On utilise souvent la PCR quantitative ou semi-quantitative sur sérum porcin pour calculer la 3charge virale3. L'idée que l'ampleur de la virémie ou la charge virale d'un tissu soit corrélée à l'expression de la maladie et le pronostic de l'infection a été démontrée comme valide. Après l'infection par le PCV2, les porcs qui ne développent pas la maladie clinique produisent des anticorps neutralisants et la virémie cesse en 3 semaines après l’infection sans dépasser probablement les 107 copies génomiques par ml, souvent moins. Les porcs atteints cliniquement présentent souvent des valeurs plus élevées et pendant plus de temps. Les résultats varient entre laboratoires, c’est pourquoi il est important que les vétérinaires soient familiarisés avec les interprétations de leur laboratoire.
Une des limites de la PCR est qu’on ne peut pas détecter de variants du virus recherché. Ceci a été évident dans la recherche récente d’un nouveau PCV2b « mutant » (appelé PCV2b mutant, mPCV2b ou PCV2d) qui a été isolé dans un élevage qui avait signalé un «échec vaccinal». L’ORF2 PCV2a/b différentiel qu’on utilisait couramment pour l’ISUVDL n’a pas détecté le nouveau PCV2, cependant, la sonde conçue pour l’ORF1 a été positive.
Ensuite on a réalisé une IHC qui a été positive au PCV2 (Opriessnig). L'idée que les sondes PCR doivent être mises à jour n'est pas nouvelle et cela a été quelque chose d’assez habituel avec des agents comme le SDRP. Quand des résultats n'ont pas de sens, ils doivent être revérifiés. Sans le feedback des vétérinaires cliniques les plus avertis, aucun laboratoire ne pourrait se mettre à jour. L'impact de la variation des souches sur l’efficacité des tests sérologiques reste encore à déterminer.
La détection des anticorps se fait souvent par ELISA ou par des techniques de séro-neutralisation. A cause de la généralisation de l’infection, la sérologie a été de peu d’aide pour le diagnostic et ses résultats doivent être interprétés avec soin. Le profil sérologique des élevages peut aider à déterminer quand se produit l’infection et peut être aussi utile pour estimer l’impact potentiel des anticorps maternels au moment de la (les vaccination(s).
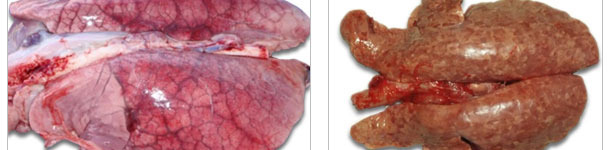
| Le syndrome d'oedème pulmonaire aigu peut être observé dans les PCVAD aigus. | Poumons foncés et indurés (typique de pneumonie interstitcielle) d'un pors avec une pneumonie associée au PCV2. |
Diagnostic et évaluation de l’impact en élevage
Le diagnostic du PCV2 sur un animal malade est encore le même que celui que Sorden a décrit il y a 14 ans. La découverte occasionnelle d'un animal avec du PCVAD dans une grande population n'est pas rare puisque l'efficacité du vaccin est rarement de 100%. Assigner automatiquement toutes les variations de la performance, la morbidité ou la mortalité au PCV2 en nous basant sur l'observation de deux porcs serait une imprudence en tenant compte de la présence d'autres pathogènes endémiques (bactéries, virus, parasites) ou d’autres facteurs qui peuvent compromettre la performance (alimentation, conduite, ambiance). Une question difficile à répondre est : comment peut-on évaluer l'impact du PCVAD sur une population vaccinée ?
Une approche systématique du diagnostic implique un suivi soigneux et systématique des porcs tout au long du temps. Souvent, le suivi simultané d’autres agents endémiques (Mycoplasma, SDRP, influenza, Actinobacillus, Haemophilus, Lawsonia, Brachyspira, Salmonella, parasites, etc. …) est plus objectif et utile que se concentrer sur la simple détection du PCV2. Le meilleur outil du diagnostic est probablement l’autopsie et l’enregistrement systématique de toutes les recherches de tous les porcs morts en engraissement. On peut prélever des échantillons de tissus dans du formol pour leur examen si le diagnostic est douteux ou si on veut écarter le PCV2. La pneumonie enzootique, l’entérite ou la pleurésie chronique sont souvent les causes de pertes significatives. Les contrôles de routine à l’abattoir peuvent améliorer le suivi. Le profil sérologique peut aider à identifier la phase ou l’âge auquel se produit l’infection. L'impact des multiples facteurs identifiés peut être noté et peut-être estimé par rapport à la perte de chance totale du potentiel productif. Par malheur on ne dispose pas encore de protocoles précis pour évaluer l'impact du PCVAD ou des infections subcliniques par le PCV2 dans les populations.