Introduction
Il s'agit d'un élevage commercial en cycle fermé (naisseur-engraisseur) en Irlande qui est passé de 600 à 1 000 truies en un an.

Le protocole de vaccination utilisé est illustré dans le tableau 1.
Tableau 1. Programme de vaccination
| Vaccin | Cochettes | Truies | Verrats | Porcelets |
| Parvovirus | Injection 2 ml le jour de la sélection | Injection 2 ml 2 semaines après mise-bas | Injection 2 ml deux fois par an | |
| Rouget | Injection 2 ml le jour de la sélection et 2 semaines avant insémination | Injection 2 ml 2 semaines après mise-bas | Injection 2 ml deux fois par an | |
| Colibacillose et Clostridiose | Injection 2 ml 6 et 2 semaines avant la mise-bas | Injection 2 ml 2 semaines avant mise-bas | ||
| SDRP (vivant atténué, oU MLV) | Injection 2 ml le jour de la sélection et 60 jours après insémination | Injection 2 ml 6 jours après mise-bas et 60 jours après insémination | Injection 2 ml deux fois par an | |
| PCV-2 | Injection 1 ml au sevrage | |||
| Pneumonie enzootique | 1 ml à 10 - 14 jours et au sevrage |
Les nullipares viennent de l'exploitation elle-même. Les verrats sont utilisés pour la détection. Les nullipares et les truies sont saillies par insémination artificielle avec du sperme provenant d'un seul fournisseur.
L'élevage le plus proche est à 2 km.
Historique
L'éleveur a contacté le vétérinaire pour une augmentation des problèmes respiratoires, la perte de l'état corporel et une augmentation de la mortalité en post-sevrage et en engraissement.
Recherche
Recherche clinique
Lors d'une visite de l'élevage en septembre 2017, de nombreux porcs âgés de 6 à 15 semaines ont été détectés avec des signes cliniques de perte de condition physique et de respiration abdominale (figures 1 et 2). Il y avait très peu de toux. La densité dans les cases était excessive.

Figure 1. Case de porcs en post-sevrage avec une densité excessive montrant des signes cliniques de perte de l'état corporel.

Figure 2. Animaux présentant des signes cliniques de perte de l'état corporel.
L'éleveur a affirmé que la mortalité entre le sevrage et l'engraissement se situait entre 3,5 et 5%. Cependant, la mortalité enregistrée sur le tableau de l'élevage était totalement différente (figure 3).

Figure 3. Performances hebdomadaires de l'unité en septembre 2017.
Selon le tableau, la mortalité du sevrage et de l'engraissement était de 8,48% au cours des 10 dernières semaines. Cette mortalité se répartissait en 2,64% dans la première phase (4 - 9 semaines de vie); 3,82% dans la deuxième phase (10-15 semaines de vie); et 1,83% à l'arrivée (de 16 semaines à l'abattoir).
Recherche de laboratoire
Deux porcelets de 6 semaines ont été euthanasiés avec respiration abdominale et perte de l'état corporel pour les autopsier à l'élevage (figure 4 et vidéo 1). Des échantillons ont été prélevés et envoyés au laboratoire pour analyse.

Figure 4. Porcelet au sevrage avec stress respiratoire et retard de croissance.
Vídéo 1. Porcelet en post-sevrage retardé et avec difficulté respiratoire.
Le tableau 2 résume les résultats de l'autopsie et du laboratoire. Les figures 5, 6, 7 et 8 montrent les résultats de l'autopsie.
Tableau 2. Résultats de laboratoire des 2 porcelets de 6 semaines en post-sevrage.
| Porcelet | Autopsie | Résultats bactériologiques | Résultats biomoléculaires | Histologie |
| 1 | Mauvaise condition physique Faible poids. Péricardite Pleurésie Consolidation pulmonaire de la région ventrale des lobes cardiaques et diaphragmatiques avec pneumonie interstitielle. |
Pasteurella multocida (poumon). Streptococcus suis sérotype 3 (poumon). |
Négatif en Mycoplasma hyopneumoniae, Virus influenza type A et PCV-2 par RT-PCR (poumon). EU-SDRP positif par RT-PCR (CT: 21.2) pool des poumons des deux porcelets. |
Bronches avec granulocytes neutrophiles et hyperplasie de l'épithélium bronchique. Le tissu pulmonaire montre différentes phases de bronchopneumonie fibrineuse. Par conséquent, l'hépatisation et la carnification sont fréquemment détectées. Il y a prolifération de tissu fibreux multifocal dans l'espace interlobulaire et interalvéolaire. Ces résultats sont représentatifs de l'inflammation chronique. |
| 2 |
Mauvaise condition physique |
Pasteurella multocida (poumon). | Négatif en Mycoplasma hyopneumoniae, Virus influenza type A et PCV-2 par RT-PCR (poumon). EU-SDRP positif par RT-PCR (CT: 21.2) pool des poumons des deux porcelets. |
Signes d'inflammation chronique dans les poumons. L'inflammation est principalement catarrhale-purulente. Les bronches sont pleines de granulocytes neutrophiles et l'épithélium bronchique est hyperplasique. La chronicité est caractérisée par la prolifération de tissu fibreux dans les espaces interstitiels. La plèvre est focalement hyperplasique et l'œdème interstitiel peut être détecté. |

Figure 5. Péricardite.

Figure 6. Pleurésie entre les plèvres pulmonaire et costale.

Figure 7. Pneumonie interstitielle avec consolidation pulmonaire marquée du lobe diaphragmatique ventral.
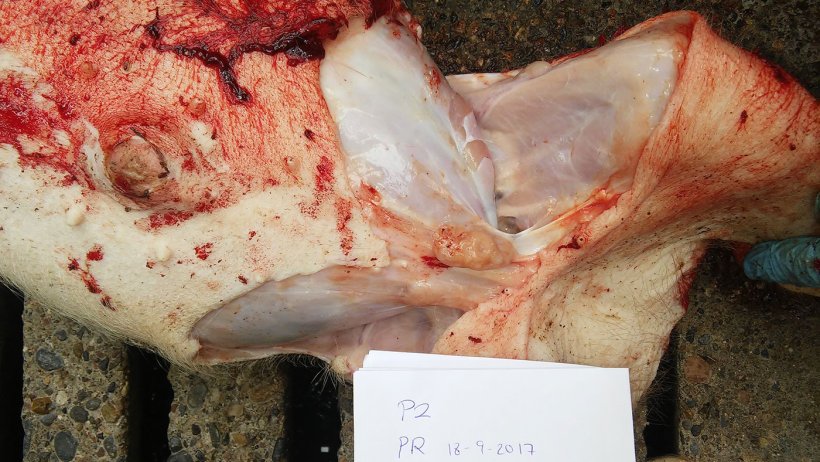
Figure 8. Ganglion lymphatique mésentérique augmenté de taille.
Diagnostic différentiel
Sur la base des investigations cliniques et de laboratoire, les diagnostics différentiels suivants ont été effectués:
- SDRP (Syndrome dysgénésique et Respiratoire Porcin).
- PCV2 (circovirus porcin de type 2).
- Virus Influenza de type A.
- Pneumonie enzootique (Mycoplasma hyopneumoniae).
Sur la base des résultats de laboratoire négatifs, des agents viraux tels que le virus de la grippe de type A et le PCV-2 ont été rejetés. Le protocole de vaccination contre PCV-2 était satisfaisant dans cette unité.
La pneumonie enzootique a également été exclue en raison des résultats de laboratoire, du programme de vaccination satisfaisant et de l'absence de toux en engraissement.
Sur la base de l'historique et des résultats de laboratoire consistants, on a pensé au SDRP avec une infection bactérienne opportuniste en engraissement.
Programme de contrôle
La vaccination avec un vaccin MLV-SDRP (MLV = Vaccin vivant modifié) a été suggérée pour tous les porcelets âgés de 10 à 14 jours.
Réponse au programme de contrôle
Il y a eu une réduction des problèmes respiratoires et des porcelets retardés. Trois mois plus tard, la mortalité a été considérablement réduite jusqu'à 5,2%. Cette mortalité se répartissait en 2,25% au premier stade (4 à 9 semaines de vie); 1,72% au second (10 à 15 semaines); et 1,24% à l'arrivée (de 16 semaines à l'abattoir) (figure 10). La densité n'a pas été modifiée.

Figure 10. Performances hebdomadaires de l'unité en février 2018.
Discussion
À la fin des années 1980, de graves troubles de la reproduction et des voies respiratoires ont été décrits aux États-Unis (Keffaber, 1989). À ce moment-là, l'agent étiologique était inconnu. En 1990, le même syndrome a été décrit en Allemagne (OIE 1992). En 1991, l'agent étiologique a été isolé aux Pays-Bas (Wensvoort et al., 1991) et a été nommé Syndrome Dysgénésique et Reproducteur Porcin (SDRP) (Terpstra et al., 1991).
L'infection par le SDRP a été diagnostiquée pour la première fois en Irlande du Nord en 1997 (anonyme, 1997) et en République d'Irlande en 1999 (Ohlinger et al.2000).
Le SRRP est présent dans la plupart des pays producteurs à quelques exceptions près; des pays tels que laSuède (Carlsson et al., 2009), la Norvège (OIE, 1997), la Finlande (Bøtner, 2003), la Suisse (Corbellini et al., 2006), la Nouvelle-Calédonie (OIE). 1996), la Nouvelle-Zélande (Motha et al. 1997), l'Australie (Garner et al., 1997), l'Argentine (Perfumo et Sanguinetti, 2003), le Brésil (Ciacci-Zanella et al., 2004) et Cuba (Alfonso et Frias Lepoureau, 2003) sont réputés indemnes.
La gravité de l'infection par le SRRP varie d'un élevage à l'autre. Les agents non infectieux peuvent exacerber l'expression des signes cliniques. Ces facteurs non infectieux comprennent la conduite, le flux des animaux, le logement et la régulation de la température (Zimmerman et al., 2012). Les infections concomitantes avec des agents viraux et bactériens potentialisent ou augmentent la sévérité de l'expression des signes cliniques du SDRP (Shibata et al., 2003, Thacker et al., 1999, Borobia et al., 2014). La pleurésie est l'une des lésions retrouvées dans les poumons des animaux infectés par le SDRP (Muirhead et Alexander, 1997). Le BPEX (2009) a constaté que l'impact économique de la pleurésie était important. L'augmentation de la prévalence de la pleurésie était associée à la réduction du poids de la carcasse et à l'augmentation de l'âge à l'abattage. Le coût pour le producteur d'une prévalence typique de pleurésie de 10% a été estimé à 2,26 £ (2,59 €) par porc.
Il a été démontré que la vaccination avec le un vaccin MLV SDRP est utile pour limiter les effets du virus sauvage chez les porcs sevrés (Waddell et al., 2008), comme on l'a vu dans ce cas clinique.






